1、计算题 接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量?千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数?。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量?千克。
参考答案:(1)31.25(2分)
(2)13.82Kg(4分)
(3)7.19%(4分)
(4)665Kg(6分)
本题解析:(1)原料气中SO2的体积分数为7%,故10m3原料气中的SO2的体积为10m3×7%=0.7m3=700L,故标准状况下二氧化硫的物质的量为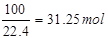 故答案为:31.25;
故答案为:31.25;
(2)原料气中O2的体积分数为11%,故10m3原料气中的O2的体积为10m3×11%=1.1m3=1100L,故标准状况下氧气的物质的量为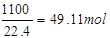 原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为
原料气中N2的体积分数为82%,故10m3原料气中的N2的体积为10m3×82%=8.2m3=8200L,故标准状况下氮气的物质的量为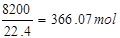 故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
故标准状况下10m3原料气的质量为:31.25mol×64g/mol+49.11mol×32g/mol+366.07mol×28g/mol=13821.48≈13.82kg,答:标准状况下10m3原料气的质量为13.82kg;
(3)SO2的转化率为99.2%,则参加反应的二氧化硫的体积为10m3×7%×99.2%=0.6944m3,则:
2SO2+O2=2SO3?体积减少△V
2? 2? 1
0.6944m3?0.6944m3? 0.3472m3
故反应后气体的体积为10m3-0.3472m3=9.6528m3,
故接触室导出的气体中SO3的体积为0.6944m3,体积分数为
答:接触室导出的气体中SO3的体积分数为7.19%;
(4)假设需要浓硫酸的质量为mg,则浓硫酸中硫酸的质量为mg×98g%=0.98mg,物质的量为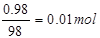 浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为
浓硫酸中水的质量为mg-0.98mg=0.02mg,物质的量为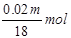 故吸收三氧化硫后生成的硫酸的物质的量为
故吸收三氧化硫后生成的硫酸的物质的量为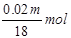 发烟硫酸中硫酸的物质的量为0.01m mol+
发烟硫酸中硫酸的物质的量为0.01m mol+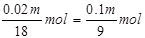 1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为
1000m3出口气体中三氧化硫的体积为1000m3×6.72%=67.2m3=67200L,SO3的物质的量为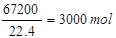 被水吸收后剩余的三氧化硫的物质的量为3000mol-
被水吸收后剩余的三氧化硫的物质的量为3000mol-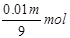
故 ,解得m=664615g=664.6kg,
,解得m=664615g=664.6kg,
答:吸收1000m3出口气体所需要的98%的硫酸的质量为664.6kg.
本题难度:一般
2、选择题 将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应现象:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
参考答案:B
本题解析:A、二者分别生成红棕色气体、无色气体,前者反应更剧烈,错误;B、Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+4H2O中1molCu消耗4molHNO3,而3Cu+8HNO3(浓)==3Cu(NO3)2+2NO↑+4H2O中1molCu消耗8/3molHNO3,故前者多、后者少,正确;C、前者生成红棕色气体,后者生成无色气体,故前者深、后者浅,错误;D、由于铜不足,则转移的电子总数应根据铜计算,由于铜质量相等,故二者应相等,错误。
本题难度:一般
3、填空题 (1)按要求写出下列各类具体反应的例子:
①两种弱酸相互反应生成两种强酸:?。
②两种弱酸盐相互反应生成两种强酸盐:?。
③两种酸溶液相互反应后溶液酸性减弱:?。
④一种酸与一种盐溶液反应后溶液酸性增强。?。
(2)广西盛产重晶石矿,其主要成分是?;以BaSO4为原料通过如下反应可制得BaS:
BaSO4+4C 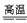 ?BaS+4CO↑
?BaS+4CO↑
①上述反应中,?元素被氧化,?是氧化剂。
②BaS与盐酸反应可制得BaCl2,在此过程中会产生污染环境的物质,消除污染的方法是?,有关的化学反应方程式是?。
参考答案:(1)①H2SO3+HClO  ?H2SO4+HCl
?H2SO4+HCl
②Na2SO3+NaClO  ?Na2SO4+NaCl
?Na2SO4+NaCl
③H2SO3+2H2S  ?3S↓+3H2O
?3S↓+3H2O
④H2S+CuSO4  ?CuS↓+H2SO4
?CuS↓+H2SO4
(2)BaSO4?①碳?硫酸钡?②将产生的气体通入NaOH溶液中? H2S+2NaOH  ?Na2S+2H2O
?Na2S+2H2O
本题解析:(1)按题目要求,选择合适的反应物并写出化学方程式,如:①H2SO3与HClO;?②Na2SO3?与?NaClO;?③H2SO3与H2S;④H2S与CuSO4。
(2)重晶石的主要成分为BaSO4;①分析所给氧化还原反应中有关元素化合价的变化可知:BaSO4中+6价的硫变为BaS中的-2价,被还原;而单质碳由0价变为CO中的+2价,被氧化;②BaS与盐酸反应制得BaCl2的同时,会产生污染环境的H2S气体,可以用NaOH溶液吸收。
本题难度:简单
4、选择题 下列实验能证明某无色气体为SO2的是?(?)
 ①能使澄清石灰水变浑浊?②能使湿润的蓝色石蕊试纸变红? ③能使品红试液褪色,加热后又显红色?④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
①能使澄清石灰水变浑浊?②能使湿润的蓝色石蕊试纸变红? ③能使品红试液褪色,加热后又显红色?④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生

A.①②③④
B.①③④
C.③④
D.②③④
参考答案:C
本题解析: 能使澄清石灰水变浑浊的气体有SO2、CO2;能使湿润的蓝色石蕊试纸变红的气体为酸性气体(如:HCl、HBr、SO2、CO2等);能使品红褪色的气体有Cl2、SO2,但Cl2有颜色,褪色后加热又显红色的只有SO2;能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀生成,只有SO2气体符合。
能使澄清石灰水变浑浊的气体有SO2、CO2;能使湿润的蓝色石蕊试纸变红的气体为酸性气体(如:HCl、HBr、SO2、CO2等);能使品红褪色的气体有Cl2、SO2,但Cl2有颜色,褪色后加热又显红色的只有SO2;能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀生成,只有SO2气体符合。
本题难度:一般
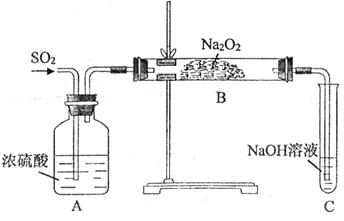
5、实验题 (11分)某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据 和
和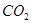 的反应,用类比的方法推理
的反应,用类比的方法推理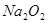 与
与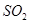 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据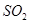 的强还原性和
的强还原性和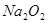 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有 。为检验生成物中是否存在
。为检验生成物中是否存在 ,他们设计了如下实验方案:
,他们设计了如下实验方案:
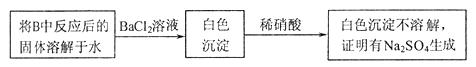
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向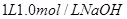 溶液中缓慢通入
溶液中缓慢通入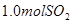 气体,请分析通入
气体,请分析通入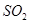 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
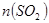 的范围 的范围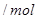
| 溶液中溶质的化学式
|
(0,0.5)
| __________
|
__________
| 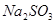 、 、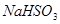
|
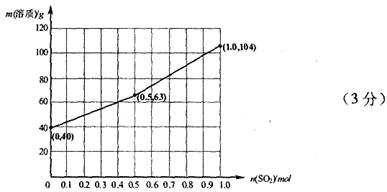
请在下图中画出溶液中溶质的总质量随缓慢通入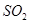 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)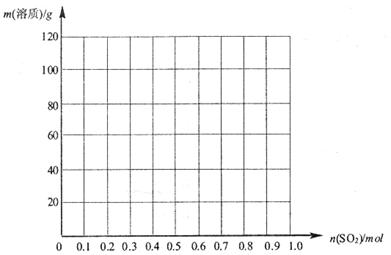
参考答案:(1)干燥 (1分)
(1分)
(2)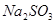 (1分);不合理(1分),
(1分);不合理(1分),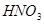 可将
可将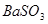 氧化为
氧化为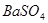 或过量的
或过量的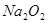 可将
可将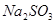 氧化为
氧化为 (1分)
(1分)
(3) 和
和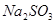 (2分);(0.5,1.0)(2分)
(2分);(0.5,1.0)(2分)
本题解析:(1)由于SO2中含有水蒸气,而水也能和过氧化钠反应,所以浓硫酸的作用是干燥SO2。
(2)过氧化钠和CO2的生成物是碳酸钠和氧气,据此类推SO2和过氧化钠反应的固体生成物应该是Na2SO3。由于稀硝酸具有氧化性,能把BaSO3氧化生成BaSO4,其次过量的过氧化钠也能把Na2SO3氧化生成Na2SO4,因此是不合理的。
(3)氢氧化钠和SO2反应的方程式为2NaOH+SO2=Na2SO3+H2O、NaOH+SO2=NaHSO3。因此根据方程式可知,如果SO2的物质的量小于0.5mol,则溶液中的溶质就是NaOH和Na2SO3;如果SO2恰好是0.5mol,则溶质只有Na2SO3;如果SO2的物质的量大于0.5mol,而小于1.0mol,则溶质是Na2SO3和NaHSO3;如果SO2恰好是1mol,则溶质只有NaHSO3。由于氢氧化钠和SO2都是1mol,所以氢氧化钠是40g,最多生成亚硫酸钠是63g,亚磷酸氢钠是104g,图像见答案。
本题难度:一般