1、填空题 已知某物质X能发生如下转化:
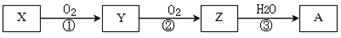
下列有关上述转化关系中物质及其反应的叙述错误的是
A.若X为N2或NH3(催化氧化),则A为硝酸
B.若X为S 或H2S(完全燃烧),则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
参考答案:D
本题解析:A. 若X为N2或NH3(催化氧化),发生反应:N2+O2 2NO,4NH3+5O2
2NO,4NH3+5O2 4NO+6H2O;2NO+O2=2NO2;3NO2+ H2O = 2HNO3+ NO。则A为硝酸,正确。B.若X为S 或H2S(完全燃烧),S+ O2
4NO+6H2O;2NO+O2=2NO2;3NO2+ H2O = 2HNO3+ NO。则A为硝酸,正确。B.若X为S 或H2S(完全燃烧),S+ O2 SO2;2H2S+ 3O2
SO2;2H2S+ 3O2 2SO2+ 2H2O;2SO2+ O2
2SO2+ 2H2O;2SO2+ O2 2SO3;SO3+H2O= H2SO4则A为硫酸。正确。C.若X为非金属单质或非金属氢化物,如C或CH4,则它们发生不完全燃烧产生CO,CO燃烧得到CO2,CO2容易水产生的是碳酸,则碳酸不能与金属铜反应生成CO。若X是S或H2S,反应得到的浓硫酸与Cu在加热时可以反应得到SO2。因此A不一定能与金属铜反应生成Y。正确。D.反应①和②一定为氧化还原反应,反应③可能为氧化还原反应3NO2+ H2O = 2HNO3+ NO,也可能是非氧化还原反应如SO3+H2O= H2SO4。错误。
2SO3;SO3+H2O= H2SO4则A为硫酸。正确。C.若X为非金属单质或非金属氢化物,如C或CH4,则它们发生不完全燃烧产生CO,CO燃烧得到CO2,CO2容易水产生的是碳酸,则碳酸不能与金属铜反应生成CO。若X是S或H2S,反应得到的浓硫酸与Cu在加热时可以反应得到SO2。因此A不一定能与金属铜反应生成Y。正确。D.反应①和②一定为氧化还原反应,反应③可能为氧化还原反应3NO2+ H2O = 2HNO3+ NO,也可能是非氧化还原反应如SO3+H2O= H2SO4。错误。
本题难度:一般
2、判断题 (12分)(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式_______________________________。
(2)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O)。写出两个反应的化学方程式
_______________________________。
参考答案:(1)CaO+SO2 CaSO3,2CaSO3+O2
CaSO3,2CaSO3+O2 2CaSO4
2CaSO4
(2)Ca(OH)2+SO2====CaSO3+H2O,2CaSO3+O2+4H2O====2(CaSO4·2H2O)
本题解析:(1)注意“固硫”的含义:不使含硫化合物进入大气。因而不包括下列?反应?:S+O2 SO2
SO2
硫煤中的硫元素大多数是以化合态存在的,游离态的单质硫很少,上列反应也不能准确表示硫煤中硫变为SO2的反应。
(2)所提供的石灰浆应该是过量的,所以不会生成Ca(HSO3)2,否则得不到CaSO4·2H2O。
本题难度:一般
3、选择题 下列关于说法或操作中不正确的是?(?)
A.不慎将水银温度计打碎在地上,可在水银上覆盖一层硫磺粉以避免发生汞中毒
B.浓H2SO4时不慎沾在皮肤上,用布擦后,用水冲洗,再用NaHCO3溶液(3-5%)冲洗
C.浓硫酸具有吸水性,因而能使蔗糖炭化
D.浓硫酸在常温下能够使铁、铝等金属钝化
参考答案:C
本题解析:浓硫酸具有吸水性,属于物理变化,而使蔗糖碳化则是化学变化,发生了脱水反应。
本题难度:简单
4、选择题 将SO2通入BaCl2溶液至饱和未见沉淀生成,继续通入某种气体仍无沉淀生成,则该气体可能是(? )
A.CO2
B.NH3
C.Cl2
D.H2S
参考答案:A
本题解析:SO2易溶于水,可溶解在BaCl2溶液中,H2O+SO2====H2SO3。若加入NH3,则2NH3+H2SO3====2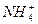 +
+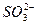 ,Ba2++
,Ba2++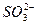 ====BaSO3↓;若加入Cl2,Cl2+H2O+H2SO3====4H++2Cl-+
====BaSO3↓;若加入Cl2,Cl2+H2O+H2SO3====4H++2Cl-+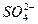 ,Ba2++
,Ba2++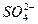 ====BaSO4↓;若加入H2S,2H2S+H2SO3====3S↓+3H2O。
====BaSO4↓;若加入H2S,2H2S+H2SO3====3S↓+3H2O。
本题难度:简单
5、填空题 浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为?。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有?。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为?。硫酸在该反应中表现的性质是?。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:?。与(2)中反应比较,反应条件不同的原因是?。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式:?。该实验中浓硫酸表现的性质有?。
参考答案:(1)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O ACE
CuSO4+SO2↑+2H2O ACE
(2)2Cu+O2+2H2SO4 2CuSO4+2H2O A
2CuSO4+2H2O A
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 过氧化氢的氧化性比氧气强
(4)2H2SO4(浓)+C CO2↑+2SO2↑+2H2O CDEF
CO2↑+2SO2↑+2H2O CDEF
本题解析:(1)浓硫酸有强氧化性,与铜共热的化学方程式为2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4
CuSO4+SO2↑+2H2O,反应中硫元素化合价由+6降到+4,浓硫酸表现了强氧化性,同时有一部分H2SO4中各元素化合价均未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量蓝色固体出现,表现了吸水性。(2)废铜屑倒入热的稀硫酸中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO4 2CuSO4+2H2O,硫酸表现出了酸性。
2CuSO4+2H2O,硫酸表现出了酸性。
(3)过氧化氢有强氧化性,常温下向过氧化氢与稀硫酸的混合溶液中加入铜片发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O,由此可证明过氧化氢的氧化性大于氧气。(4)根据题给现象,说明浓硫酸有脱水性、吸水性、强氧化性,同时,浓硫酸溶于水会放出大量的热,可发生反应2H2SO4(浓)+C CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
本题难度:一般