1、选择题 下列离子方程式书写正确的是
A.铝与氢氧化钠溶液反应:Al + 2OH-=AlO2-+ H2↑
B.偏铝酸钠溶液中加入氯化铝溶液:Al3+ +3AlO2-+ 6H2O = 4Al(OH)3 ↓
C.醋酸去除水垢:CaCO3 +2H+ = Ca2+ + CO2↑+H2O
D.等体积等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合:Ba2+ +2OH-+2HCO3-="?" BaCO3↓+CO32-+2H2O
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列离子方程式正确的是?(?)
A.用醋酸除去水垢:

B.苯酚与碳酸钠反应: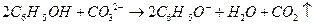
C.苯酚钠溶液中通入少量CO2: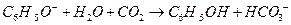
D.乙酸乙酯与氢氧化钠溶液反应:
参考答案:C
本题解析:A项,醋酸属于弱酸,不能拆成离子形式,正确写法是
 ;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是
;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是 。
。
本题难度:简单
3、选择题 Fe3+、SO42–、Al3+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是
A.Na+
B.OH —
C.CO32—
D.Cl—
参考答案:D
本题解析:试题分析:铁离子、铝离子和OH-以及CO32—等都不能大量共存。根据离子的物质的量之比可知,溶液中负电荷数多于正电荷数,因此溶液的电中性可知,X应该是氯离子,答案选D。
考点:考查离子共存以及离子浓度大小比较等
点评:在判断溶液中离子种类时,除了首先利用共存关系判断外,有时还需要借助于电荷守恒进行,在答题时需要注意到。
本题难度:简单
4、选择题 下列离子方程式正确的是
A.铁与盐酸的反应:Fe+2H+=Fe3++H2↑
B.碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.硫酸氢钾与氢氧化钠:OH-+H+=H2O
参考答案:D
本题解析:分析:A、铁和盐酸反应生成氯化亚铁和氢气;
B、醋酸为弱电解质;
C、不遵循电荷守恒;
D、硫酸氢钾为强电解质,与NaOH溶液反应的实质为氢离子与氢氧根离子反应.
解答:A、铁与盐酸的反应的这里反应为Fe+2H+=Fe2++H2↑,而不是Fe3+,故A错误;
B、碳酸钡溶于醋酸的离子反应为BaCO3+2HAc═Ba2++2Ac-+H2O+CO2↑,故B错误;
C、铜片插入硝酸银溶液中的离子反应为Cu+2Ag+=Cu2++2Ag,故C错误;
D、硫酸氢钾与氢氧化钠反应的实质为氢离子与氢氧根离子反应,离子反应为OH-+H+=H2O,故D正确;
故选D.
点评:本题考查离子方程式书写的正误判断,明确反应的实质及离子反应方程式书写的注意事项即可解答,难度不大.
本题难度:困难
5、选择题 在酸性溶液中,下列离子能大量共存的是
A.NH4+、Ba2+、SO42-、CL-
B.K+、Fe3+、CL-、OH-
C.K+、Na+、CO32-、SO42-
D.Na+、K+、NO3-、SO42-
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之可以。A中生成硫酸钡沉淀,B中OH-不能大量共存,C中CO32-不能大量共存,所以正确的答案选D。
本题难度:困难