1、填空题 (1)现有34g某气体,它的摩尔质量为17g·mol-1。则:
① 该气体的物质的量为___________mol。
② 该气体所含分子数为___________NA。
③ 该气体在标况下的体积为___________L。
④ 该气体完全溶于500mL水后稀释到2L,物质的量浓度为___________mol·L-1。
(2)将100mL 0.5mol/L Na2CO3溶液加水稀释到250mL,稀释后c(Na+)=___________mol·L-1。
(3)___________gH2O中的O原子数目与标况下22.4LCO2中的O原子数目相同。
参考答案:(1)①2;②2;③44.8;④1
(2)0.4
(3)36
本题解析:
本题难度:一般
2、选择题 设nA是阿伏加德罗常数的数值,下列说法正确的是
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5nA
B.4.2 g丙烯中所含的共价键数目为0.6nA
C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 nA
D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 nA
参考答案:A
本题解析:若只有二氧化氮,其相对分子质量为46,则23g二氧化氮的物质的量为0.5mol,含有0.5mol氮原子,若只有四氧化二氮,其相对分子质量为92,则23g四氧化二氮的物质的量为0.25mol,也含有0.5mol氮原子,若既有二氧化氮又有四氧化二氮,则23g混合气体中含有0.5mol氮原子,故A选项正确;丙烯的分子式为C3H6,相对分子质量为42,则4.2g丙烯的物质的量为0.1mol,1个丙烯中含有6个C—H键、1个C—C键、1个C=C键,则0.1mol丙烯中含有0.6molC—H键、0.1molC—C键、0.1mol C=C键,故B选项错误;由于n=c?V,则硫酸铁的物质的量为0.1mol,由于Fe2(SO4)3=2Fe3++3SO42—中铁离子与硫酸铁的系数之比等于物质的量之比,则0.1mol硫酸铁含有0.2mol铁离子,由于铁离子部分水解,则溶液中铁离子小于0.2mol,故C选项错误;由于n=V/Vm,标准状况下气体摩尔体积为22.4L/mol,则氧气的物质的量为0.05mol,由于2H2O2=2H2O+O2↑~2e—,其中转移电子与氧气的系数之比等于物质的量,则该反应中转移电子的物质的量为0.1mol,故D选项错误。
本题难度:一般
3、选择题 下列溶液中的氯离子浓度 与50 mL? 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是(?)
A.150 mL 1 mol·L-1的NaCl
B.25 mL 2 mol·L-1的FeCl3
C.150 mL 3 mol·L-1的KCl
D.75 mL 2 mol·L-1的CaCl2
参考答案:C
本题解析:50mL1 mol·L-1的AlCl3溶液中的Cl-浓度为3 mol·L-1,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度。A、1 mol·L-1的NaCl 中Cl-浓度为1 mol·L-1,错误;B、2 mol·L-1的FeCl3中Cl-浓度为6 mol·L-1,错误;C、3 mol·L-1的KCl 中Cl-浓度为3 mol·L-1,正确;D、2 mol·L-1的CaCl2 Cl-浓度为4 mol·L-1,错误。
本题难度:一般
4、选择题 下列叙述中,正确的是
A.1 mol 过氧化钠中阴离子个数为2×6.02×1023
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为6.02×1023
C.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
参考答案:B
本题解析:A、O22?为1个阴离子,所以1 mol 过氧化钠中阴离子个数为6.02×1023,错误;B、乙烯和丙烯的最简式都是CH2,所以14 g乙烯和丙烯的混合物中含有的碳原子的数目为:14g÷14g/mol×6.02×1023mol-1=6.02×1023,正确;C、28 g C18O中含有的质子数为:28g÷30g/mol×6.02×1023mol-1,错误;D、.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为6.02×1023,错误。
本题难度:一般
5、简答题 化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
实验室需要0.1mol?L-1?NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
(2)下列操作中,容量瓶所不具备的功能有______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol?L-1(填“大于”、“等于”或“小于”).
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL(计算结果保留一位小数).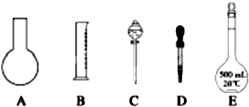
参考答案:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以不需要的仪器是AC,还需要的仪器是烧杯和玻璃棒.
故答案为:AC;玻璃棒、烧杯;
(2)容量瓶不能用于贮存、加热溶液,溶解固体溶质等,只有1个刻度线不能测量容量瓶规格以下的任意体积的液体,故答案为:BCEF;
(3)m=nM=CVM=0.1mol/L×0.5L×40g/mol=2g,在容量瓶中定容时俯视容量瓶刻度线,导致溶液的体积偏小,所以配制溶液的浓度偏大,故答案为:2.0;大于;
(4)浓硫酸的物质的量浓度为:c=103ρwM=103×1.84×98%98mol/L=18.4mol/L;设需要浓硫酸的体积为V,0.5mol/L×0.5L=18.4mol/L×V,V=0.0136L=13.6mL,故答案为:13.6.
本题解析:
本题难度:一般