1、选择题 已知一些银盐的颜色及溶解度数值如下:
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4
颜色
白色
浅黄色
黄色
黑色
红色
溶解度/g
1.5×10-4
7.1×10-7
2.1×10-7
1.3×10-16
4.3×10-2
|
测定水体中氯化物的含量,常用标准硝酸银法进行滴定.滴定时,应加入的指示剂是( )
A.KBr
B.KI
C.K2S
D.K2CrO4
参考答案:本题的指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点;
A、氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A不选;
B、依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B不选;
C、硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=1.3×10-16,计算得到需要的银离子浓度c(S2-)=31.3×10-162
本题解析:
本题难度:一般
2、实验题 (1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中?沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L—1的硫酸溶液中,充分反应后溶液中各离子浓度大小为?(按由大到小的顺序写出各离子符号)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为?.(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(4)用下图完成相应实验.
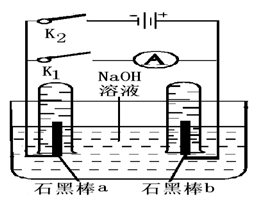
①断开K1,闭合K2接通直流电源,写出阳极?的电极反应?.
电解的总反应方程式?
②电解一段时间后,当两石墨棒均有气体包围时,切断K2闭合K1,发现电路中有电流通过. 写出a极的电极反应式?
参考答案:(1)无(3分)
(2)NH4+;SO42-;OH-;H+ (3分)
(3) 2.5×10-3 mol·L-1?(3分)
(4) ①4OH-→2H2O+O2↑+4e- (3分); 2H2O  ?2H2↑+O2↑(3分)
?2H2↑+O2↑(3分)
② 2H2+4OH-→ 4H2O+4e- (3分)
本题解析:略
本题难度:一般
3、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA-? HA- H++A2-?完成以下问题:
H++A2-?完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
参考答案:(1) 碱性? B2-+H2O  ?HA-+OH-? (2) < ?(3)1.75×10-4
?HA-+OH-? (2) < ?(3)1.75×10-4
本题解析:二元酸(化学式用H2A表示)在水中的电离方程式是:H2A==H++HA-? HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O  ?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32-
?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32- CaCO3(1)+ SO42-的平衡常数
CaCO3(1)+ SO42-的平衡常数
K=c(SO42-)/c(CO32-)=Ksp[CaSO4]/Ksp[CaCO3]=4.90×10-5/=2.80×10-9=1.75×104。
点评:本题考查了盐的水解、溶度积,该题要理解二元酸在水中的电离方程式是:H2A==H++HA-
HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
本题难度:一般
4、选择题 己知CuSO4溶液分别与 Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++CO32-+H2O→Cu(OH)2↓+CO2 ↑;次要:Cu2++CO32-→CuCO3 ↓
(2)CuSO4 + Na2S主要:Cu2++S2-→CuS↓;次要:Cu2++S2-+2H2O→Cu(OH)2↓+H2S ↑
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS