1、填空题 某火电厂的脱硫尾气通入饱和K2CO3溶液吸收池后,经分解池制得纯净的CO2,再在合成塔与H2反应生成甲醇。其工艺艺流程示意图如下:

(1)吸收池中饱和K2CO3溶液吸收CO2的离子方程式是 。
(2)流程示意图中循环使用的物质是 。
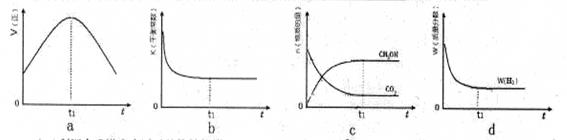
(3)300℃时,合成塔中的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
CH3OH(g)+H2O(g),在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是 (填字母序号)
(4)利用合成塔中失活后的铬锌触媒可制得含有Cl- 和CrO42- 的溶液,其浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的AgNO3溶液时,首先产生沉淀的阴离子是 (已知:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12)
(5)合成塔中失活的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:Zn(s) +2MnO2(s) +H2O(l) = Zn(OH)2(s) +Mn2O3(s) ,该电池正极的电极反应式是 。若用电池电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,电解过程中阴极的现象是 。
参考答案:(1)CO2+CO32-+H2O=2HCO3-
(2)K2CO3
(3)cd
(4)Cl-
(5)2MnO2+2e-+H2O=2OH-+Mn2O3 有无色气体和白色沉淀产生
本题解析:(1)K2CO3溶液的吸收CO2生成KHCO3,将K+删除写成离子方程式。
(2)KHCO3受热分解又得到K2CO3,这是循环物质;
(3)反应达到平衡状态又两个特征:一是v(正)= v(逆);二是各物质组分含量不变。a图像没有说明逆反应的速率,不能确定;b是反应得到平衡的常数K,与反应是否达到平衡无关,与温度有关,b不能判断平衡与否;c中的CH3OH和CO2的物质的量不变,即组分不变,说明得到平衡状态;d是H2的含量分数不变,也是组分恒定,说明得到平衡状态。
(4)0.01mol/L Cl-,开始沉淀时c(Ag+)=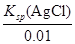 =1.56×10-8;0.01mol/L CrO42-,开始沉淀时c(Ag+)=
=1.56×10-8;0.01mol/L CrO42-,开始沉淀时c(Ag+)=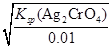 =3.0×10-5。故Cl-先沉淀。
=3.0×10-5。故Cl-先沉淀。
(5)氧化剂MnO2做正极材料,得电子,生成Mn2O3,注意环境,故生成OH-。电解(惰性电极)足量的Mg(NO3)2和NaCl的混合溶液,根据放电顺序,阳极Cl-放电,阴极水电离的H+放电,产生OH-,与Mg2+结合生成Mg(OH) 2白色沉淀。
考点:化学流程为载体,考查化学平衡图像、难溶物的Ksp计算及电化学反应原理。
本题难度:困难
2、填空题 (1)某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、?SO32-、SO42-、NO3-和NO2-等。为确定其组成,分别进行下列4组实验
①其中能确认样品中不含SO32-的实验操作是________(填下列实验操作序号);
根据实验结果,你认为是否含有NO2-?________(填“含有”、“不含有”),其原因是________________;
A.取试样,滴加适量的淀粉KI溶液,呈蓝色;
B.取试样,滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
C.取试样,滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
D.取试样,滴加酸性KMnO4溶液,不褪色。
②书写A实验现象的离子方程________________,C?实验说明酸雨中含________________?
(2)某废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的一种处理方法为还原沉淀法。该法的工艺流程为:?

其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①第①步中若平衡体系的pH=1,该溶液中含Cr元素的微粒是__________________。
②第②步中,还原1molCr2O72-离子,需要__________mol的FeSO4·7H2O。
③第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
Cr3+(aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_____。
参考答案:(1) D;不含有;样品中滴加酸性高锰酸钾溶液不褪色;②2NO3- +6I-?+ 8H+ =2NO↑ + 3I2?+?4H2O;NH4+
(2)①Cr2O72-;②6;③?5
本题解析:
本题难度:一般
3、选择题 下列说法正确的是(?)
A.水垢的主要成分是MgCO3和CaCO3
B.硬水的软化是将全部的Mg2+、Ca2+除尽
C.加入FeS、MnS以除去工业废水中的Cu2+、Cd2+、Pb2+等重金属离子
D.胃舒平的主要成份是氢氧化铁,可治疗胃酸过量,同时也可补铁。
参考答案:C
本题解析:由于持续加热,将MgCO3转化成更难溶的Mg(OH)2,故水垢的主要成分是Mg(OH)2和CaCO3。硬水的软化:除去其中少量的Mg2+、Ca2+,并非一定要除尽,而只是尽量降低它们的浓度。加入FeS、MnS是将废水中的Cu2+、Cd2+、Pb2+等重金属离子转化成更难溶的沉淀CuS、CdS、PbS而除去。胃舒平的主要成份是氢氧化铝,可治疗胃酸过量。
本题难度:简单
4、选择题 向AgCl饱和溶液中滴加足量NaBr溶液,产生淡黄色沉淀,再向溶液中滴加KI溶液,又产生黄色沉淀。有关下列说法正确的是
A.产生的淡黄色沉淀为AgI
B.产生的黄色沉淀为AgBr
C.由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl)
D.上述实验现象说明沉淀可相互转化