1、选择题 常温下,某溶液中水电离出的[OH-]=1×10-11mol·L-1,则该溶液不可能是:
A.NaOH溶液
B.NaHSO4溶液
C.NH4Cl溶液
D.0.001mol·L-1的CH3COOH溶液
参考答案:CD
本题解析:
【错解分析】选项D往往误认为醋酸属于酸类,其电离的氢离子抑制了水的电离,因此漏选该选项。其实选项D给了醋酸的浓度,由于醋酸是弱酸,只有微弱的电离,
[H+]=C·a=0.001a<1×10-3mol·L-1
因此水电离出的氢氧根离子浓度应大于1×10-11mol·L-1,所以该选项也为本题正确选项。硫酸氢钠虽属于盐类,然而在中学范围内,将其视为强酸溶液(应为中强)。一定浓度的该溶液,其氢离子浓度可达到1×10-3mol·L-1,满足题目的要求。
【正解】水电离出的氢氧根离子浓度小于1×10-7mol·L-1,说明溶液中水的电离受到电解质离子的抑制,而该电解质应是能电离生成氢离子或氢氧根离子的物质。本题备选答案C中的氯化铵属于强酸弱碱盐,其溶于水发生水解,促进水的电离,因此水电离出的氢离子和氢氧根离子浓度大于1×10-7mol·L-1,其中氢氧根离子中的大部分和铵根离子结合生成弱电解质,溶液中剩余的氢氧根离子浓度和氢离子浓度保持水的离子积。题目给出的信息是水电离出的[OH-]=1×10-11mol·L-1,与上述分析矛盾,该选项为正确选项。
本题难度:简单
2、选择题 下列溶液中微粒浓度关系一定正确的是
A 均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B? 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C? 25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
参考答案:A
本题解析:A中HSO4-显酸性,对NH4+水解起抑制作用,NH4HSO4中大于NH4Cl中NH4+浓度,A正确。Kw与温度有关,升高温度,Kw增大,B错;对于强碱来说,每稀释10倍,pH下降1个单位,由于弱碱部分电离,加水促进其电离,所以OH-的物质的量浓度当稀释相同的倍数时,弱碱碱性要比强碱要强,C错;从已知条件看部分电离的OH-与完全出的H+“刚好”中和,但氨水水的物质的量浓度要比盐酸在大,反后氨水过量,中和后显碱性,D错;答案选A。
本题难度:一般
3、选择题 表示氢气燃烧热的是( )
A.H2(g)+
O2(g)=H2O(g)△H=-241.8?kJ/mol
B.2H2(g)+O2(g)=2H2O(g)△H=-483.6?kJ/mol
C.H2(g)+O2(g)=H2O(l)△H=-285.8?kJ/mol
D.2H2(g)+O2(g)=2H2O(l)△H=-571.6?kJ/mol
参考答案:A、水的状态为气态,产物为不是稳定氧化物,△H不代表燃烧热,故A错误;
B、氢气的化学计量数为2,△H不代表燃烧热,故B错误;
C、H2的化学计量数为1,产物是稳定氧化物,△H代表燃烧热,故C正确;
D、H2的化学计量数为2,产物是稳定氧化物,△H不代表燃烧热,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于(?)
A.9.0
B.9.5
C.10.5
D.11.5
参考答案:C
本题解析:1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,根据中和反应的特点可以知道,盐酸中氢离子的物质的量为碱中氢氧根离子物质的量,即1×10-2.5=10×c,所以C=10-3.5,故pOH=-lgc(OH-)=3.5,所以pH=14-3.5=10.5,所以本题的答案选择C。
点评:本题考查了pH的计算,该考点是高考考查的重点和难点,本题难度适中。
本题难度:一般
5、填空题 某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如下图所示.
mol/L,x与y的关系如下图所示.

请回答下列问题:
(1)此温度时,水的离子积Kw为 ,?则该温度t 25℃(填“>”“<”“=”).
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L
与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
②若所得混合液的pH=2,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
参考答案:
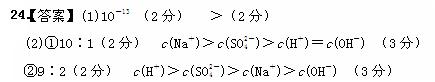
本题解析:略
本题难度:一般