1、选择题 某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol?L1的H2A溶液
② 0.01mol?L1的NaHA溶液
③ 0.02mol?L1的HCl溶液与0.04mol?L1的NaHA溶液等体积混合
④ 0.02mol?L1的NaOH溶液与0.02mol?L1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是(?)
A.溶液②中存在水解平衡:HA―+H2O 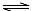 H2A+OH―
H2A+OH―
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c (HA-)浓度大小:③>①>②>④
2、选择题 下列热化学方程式书写正确的是(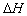 的绝对值均正确)(?)
的绝对值均正确)(?)
A.C2H5OH(l)+3O2(g) = 2CO2 (g)+3H2O(g)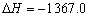 kJ/mol(燃烧热)
kJ/mol(燃烧热)
B.NaOH(aq)+HCl (aq) = NaCl (aq) +H2O(l)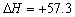 kJ/mol(中和热)
kJ/mol(中和热)
C.S(s)+O2(g) = SO2(g) kJ/mol(反应热)
kJ/mol(反应热)
D.Fe+S = FeS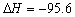 kJ/mol(反应热)
kJ/mol(反应热)
3、填空题 (12分)已知下列热化学方程式:①H2(g) + O2(g)=H2O(l);ΔH="-285" kJ·mol-1
O2(g)=H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +1/2 O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1?
③C(s) +1/2 O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g);ΔH="-393.5" kJ·mol-1?
回答下列问题:
(1)H2的燃烧热ΔH为?;C的燃烧热ΔH为?。
(2)燃烧1gH2生成液态水,放出的热量为?。
(3)写出CO燃烧的热化学方程式?。
4、填空题 设水的电离平衡线如图所示。
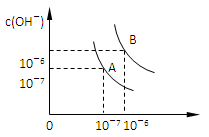
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从________增加到______。
(2)pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积 比为_________。
比为_________。
(3)若在某温度下,重水( D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
D2O)的离子积常数为1×10-12。若用pH一样的定义来规定pD值,则pD=-lg{ c(D+)}。该温度下:纯重水的pD=_____,1L溶有0.01molNaOD的D2O溶液,其pD="___" ,1 00mL0.1mol/L的D2SO4溶液与100mL0.4mol/L的KOD的D2O溶液混合,pD=______。
5、选择题 已知在100℃的温度下(本题涉及的溶液其温度均为100℃,水的离子积KW=1.0×10-12 mol2·L-2。下列说法中正确的是
A.0.05 mol·L-1的H2SO4溶液,pH=1
B.0.001 mol·L-1的NaOH溶液,pH=11
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL