| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子共存》高频考点预测(2019年最新版)(二)
参考答案:A 本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。B中Fe3+能氧化I-,另外Fe3+和HCO3-水解相互促进,不能大量共存;C中Ag+和PO43-、Cl-均可以生成沉淀,不能大量共存;D中Al3+和CO32-水解相互促进,Mg2+和CO32-生成沉淀,都不能大量共存,答案选A。 本题难度:困难 2、选择题 常温下,下列各组离子在所给条件下能够大量共存的是( ) 参考答案:B D 本题解析:A.Cu2+在溶液中显蓝色,不能存在于透明溶液中,该项不符合; 本题难度:简单 3、选择题 下列各组离子,在指定的环境中一定能大量共存的是 |
参考答案:B
本题解析:A、Fe3+与SCN-反应生成红色溶液,不能大量共存,错误;B、含有大量HCO3-的溶液中四种离子都不反应,可以大量共存,正确;C、S2-与ClO-发生氧化还原反应不能大量共存,错误;D、酸性溶液中MnO4-与SO32-发生氧化还原反应不能大量共存,错误,答案选B。
考点:考查给定条件的离子大量共存的判断
本题难度:一般
4、选择题 已知pH=1的某溶液中含有较多的Ag+和Na+,则溶液中可能大量存在的是?( ?)
A.NO3-
B.CO32-
C.F-
D.Cl-
参考答案:A
本题解析:NO3-在酸性条件下可与Ag+、Na+共存,Ag+与CO32-和Cl-不共存,F-在pH=1的酸性溶液中也不能大量共存,会产生HF。
本题难度:一般
5、填空题 (1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_____________________。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中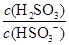 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
参考答案:(1)Al(OH)3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(2)10∶1
(3)2×10-9/(c-0.02) (4)1.0×10-12 增大
本题解析:(1)根据溶度积常数表达式可知,生成Mg(OH)2沉淀时需要的OH-浓度是  =4.2×10-5mol/L;同样可知生成氢氧化铝沉淀时需要的OH-浓度是
=4.2×10-5mol/L;同样可知生成氢氧化铝沉淀时需要的OH-浓度是 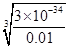 =3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓ +3NH4+。
=3.1×10-11mol/L,所以首先生成的是氢氧化铝沉淀,反应的离子方程式是Al3++3NH3·H2O=Al(OH)3↓ +3NH4+。
(2)0.01 mol·L-1的NaOH溶液的pH=11,所以溶液中氢离子浓度是1×10-11mol/L,而OH-浓度是0.01 mol/L,则该温度下水的离子积常数KW=10-13。pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VaL混合,若所得混合液为中性,则Va×0.01=Vb×0.2,所以Va∶Vb=10∶1。
(3)c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-)=0.01 mol/L,而溶液中氢离子浓度是1×10-7mol/L,根据物料守恒可知,溶液中醋酸的浓度是0.5 c-0.01,该温度下醋酸的电离常数 Ka=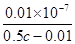 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
(4)Ka=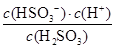 ,HSO3-+H2O
,HSO3-+H2O H2SO3+OH-,Kb=
H2SO3+OH-,Kb=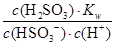 =
=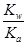 =
=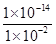 =1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则
=1.0×10-12,当加入少量I2时,溶液酸性增强,c(H+)增大,但是温度不变,Kb不变,则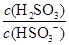 增大。
增大。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质组成与.. | |