1、选择题 下列分子或离子的中心原子,含有孤对电子的是
A.BF3
B.CH4
C.NH4+
D.H2O
参考答案:D
本题解析:
本题难度:简单
2、选择题 131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关131 53I的叙述中错误的是:
A.131 53I的原子序数为53
B.131 53I的原子核外电子数为78
C.131 53I的化学性质与127 53I相同
D.131 53I的原子核内中子数多于质子数
参考答案:B
本题解析:试题分析:131 53I表示的是碘元素的原子序数为53 ,原子核外电子数为53,质量数为131,中子数为78,所以A、D正确,B错误,答案为B,131 53I与127 53I为同位素,化学性质相同,所以C的叙述是正确的。
考点:元素,同位素
点评:本题考查了元素,同位素的相关知识,属于高考的常考考点,本题不难,但要注意题干是要选择叙述错误的。
本题难度:简单
3、选择题 可用来鉴别Na2CO3溶液和NaHCO3溶液的方法是
A.加入澄清的石灰水
B.分别加热
C.加KCl溶液
D.加CaCl2溶液
参考答案:D
本题解析:Na2CO3与CaCl2反应生成CaCO3沉淀,而NaHCO3与CaCl2不反应.
本题难度:一般
4、选择题 水分子间可通过一种叫“氢键”的作用(介于化学键和范德瓦耳斯力大小之间),彼此结合而形成(H2O)n,在冰中的n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图1-11所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的是
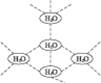
图1-11
A.1 mol冰中有4 mol氢键
B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键
D.平均每个水分子只有5/4个氢键
参考答案:C
本题解析:在冰中每个水分子被4个水分子包围,即每2个水分子间存在一个氢键,每个氢键为2个水分子共用,在一个氢键中,每个水分子平均拥有1/2个氢键,而每个水分子可形成4个氢键,所以每个水分子平均含有氢键为:1/2×4=2个,也就是说1 mol冰中有2 mol“氢键”。
本题难度:简单
5、选择题 下列含有共价键的离子化合物是
A.HI
B.Na2O2
C.Br2
D.NaCl
参考答案:B
本题解析:考查化学键的判断。一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以A中含有极性键,是共价化合物。B中含有离子键和极性键,是离子化合物。C中含有非极性键是单质。D中含有离子键,是离子化合物。答案选B。
本题难度:一般