1、选择题 “类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是
A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3
B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
D.干冰(CO2)是分子晶体;则二氧化硅(SiO2)也是分子晶体
参考答案:B
本题解析:氨气分子中存在氢键,所以沸点要高于AsH3的,即顺序为NH3>AsH3 >PH3。晶体中有阳离子,不一定有阴离子,例如金属晶体。二氧化硅(SiO2)是原子晶体,所以答案选B。
本题难度:一般
2、选择题 下列各组中的两种物质不易用物理性质区别的是
A.苯和四氯化碳
B.酒精和汽油
C.氯化铵和硝酸铵晶体
D.碘和高锰酸钾固体
参考答案:C
本题解析:苯的密度比水小,四氯化碳的密度比水大,二者在水中分别居上层、下层,可用物理性质区别.酒精与水互溶,汽油不溶于水且密度比水小,可用物理性质区别.碘易升华,高锰酸钾不易升华,可用物理性质区别.氯化铵和硝酸铵均为白色晶体,都易溶于水,且溶液均为无色,很难用物理性质区别.
本题难度:简单
3、选择题 如图是CaF2晶胞的结构。下列说法正确的是
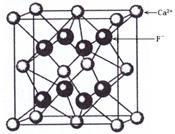
A.一个CaF2晶胞中含有8个Ca2+
B.一个CaF2晶胞中含有8个F-
C.在CaF2晶胞中Ca2+的配位数为4
D.在CaF2晶胞中F-的配位数为8
参考答案:B
本题解析:根据晶胞结构可知,一个CaF2晶胞中含有的Ca2+和F-的个数分别为8×1/8+6×1/2=4,8×1=8,所以A不正确,B正确。配位数是指一个离子周围最邻近的异电性离子的数目。所以根据晶胞的结构可判断Ca2+的配位数是8,F-的配位数是4,即选项CD都是错误的。答案选B。
本题难度:简单
4、选择题 元素化学性质随着原子序数的递增呈现周期性变化的原因是
A.原子半径的周期性变化
B.非金属性的周期性变化
C.元素化合价的周期性变化
D.原子核外电子排布的周期性变化
参考答案:D
本题解析:试题分析:元素化学性质随着原子序数的递增呈现周期性变化的原因是原子核外电子排布的周期性变化的必然结果,答案选D。
考点:该题是基础性试题的考查,难度不大。记住元素周期律的实质即可,有利于培养学生的逻辑推理能力,提高学生的学习效率和应试能力。
点评:
本题难度:简单
5、选择题 能够用来鉴别BaCl2、NaCl、Na2CO3三种物质的试剂是
A.AgNO3溶液
B.稀HCl
C.稀H2SO4
D.稀HNO3
参考答案:C
本题解析:
本题难度:一般