1、选择题 在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对于延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为
[? ]
A.硫
B.砷
C.硒
D.硅
参考答案:C
本题解析:
本题难度:简单
2、填空题 (1)图表法、图象法是常用的科学研究方法。短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第_______族。
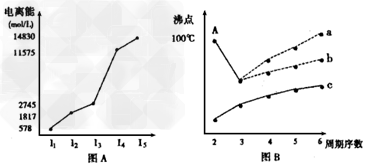
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可表达第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:_______?(填“a”或“b”),理由是:___________________________________。
(3)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为______________;
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
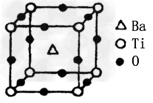
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是_______;晶体内与每个“Ti”紧邻的氧原子数为_______个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的23。
则绿色晶体配合物的化学式为______________。
参考答案:(1)IIIA
(2)IVA;b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水
(3)I.3d24s2;II.①BaTiO3;6;②[TiCl(H2O)5]Cl2·H2O
本题解析:
本题难度:一般
3、选择题 两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:①m-4?②m+4?③m+8?④m-2?⑤m+6.其中正确的组合是( )
A.①②④
B.①②③④⑤
C.①②③⑤
D.①②⑤
参考答案:两种短周期元素X和Y可组成化合物XY3,则X为ⅢA族元素时,Y为ⅤⅡA族元素;或X、Y均为ⅥA族元素;还有可能为X在ⅤA族,Y为ⅤⅡA族或H,
①若Y为Cl,X为Al,则X的原子序数为m-4,故①正确;
②若Y为F,X为Al,则X的原子序数为m+4,故②正确;
③若Y为S,X为O,则X的原子序数为m+8,故③正确;
④若Y为Cl,X为P,则X的原子序数为m-2,故④正确;
⑤若Y为H,X为N,则X的原子序数为m+6,故⑤正确;
故选B.
本题解析:
本题难度:简单
4、选择题 现在含有元素硒的保健品已开始进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中不正确的是
A.得电子能力比溴强
B.最高价氧化物的化学式SeO3
C.原子序数为34
D.气态氢化物的化学式为H2Se
参考答案:A
本题解析:此题考查同周期、同主族元素性质的递变规律.可以确定出硒在周期表中的位置是第四周期第六主族,而和溴同周期,但在溴的左边,故非金属性比溴弱,所以得到电子的能力比溴弱,因此A错.由于与氧同族,所以,最高价氧化物的化学式和SO3相似,因此B对;气态氢化物和水相似,故D对;其原子序数可以用16+18来计算,所以C也对.
本题难度:简单
5、选择题 几种短周期元素的原子半径及主要化合价如下表:
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
参考答案:C
本题解析:试题分析:X是短周期中最活泼的金属,且与R同周期,因此X是Na。R的最高价是+3价,则R是Al。Y和M的化合价都有-2价,应为周期表第ⅥA族元素,Y的最高价为+6价,应为S元素,M无正价,应为O元素;Z的化合价为+5、-3价,应为周期表第ⅤA族,原子半径小于硫元素原子半径而大于氧元素原子半径,故处于第二周期,为N元素。A、电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Al3+,故A正确;B、Z与M组成的化合物是NO或NO2,均是形成硝酸型酸雨的原因之一,故B正确;C、SO2溶于水显酸性,因此将SO2通入BaCl2溶液中,不能反应生成亚硫酸钡白色沉淀,故C错误;D、氢氧化铝属于两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水,故D正确,答案选C。
考点:考查元素周期表的结构以及元素周期律的应用
本题难度:简单