1、选择题 反应(1)、(2)分别是从海藻灰和智利硝石中提取碘的主要反应:
(1)2NaI+MnO2+3H2SO4====2NaHSO4+MnSO4+2H2O+I2
(2)2NaIO3+5NaHSO3====2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是(? )
A.两个反应中NaHSO4均为氧化产物
B.I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C.氧化性:MnO2>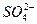 >
>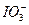 >I2
>I2
D.反应(1)、(2)中生成等量的I2时转移电子数比为1∶5
参考答案:D
本题解析:首先标化合价看价变化:
2Na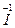 +
+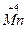 O2+3H2SO4====2NaHSO4+
O2+3H2SO4====2NaHSO4+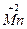 SO4+2H2O+
SO4+2H2O+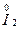 ,I的化合价升高,I2是氧化产物,NaHSO4中的元素化合价没有变化,既不是氧化产物也不是还原产物,氧化性:MnO2>I2,生成1 mol I2转移2 mol电子;
,I的化合价升高,I2是氧化产物,NaHSO4中的元素化合价没有变化,既不是氧化产物也不是还原产物,氧化性:MnO2>I2,生成1 mol I2转移2 mol电子;
 ====
====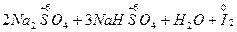 ,I的化合价降低,I2是还原产物,Na2SO4、NaHSO4是氧化产物,氧化性:
,I的化合价降低,I2是还原产物,Na2SO4、NaHSO4是氧化产物,氧化性: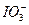 >
>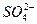 ,生成1 mol I2转移10 mol电子。
,生成1 mol I2转移10 mol电子。
本题难度:简单
2、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+2CO2↑+K2SO4+2H2O,下列说法正确的是
2ClO2↑+2CO2↑+K2SO4+2H2O,下列说法正确的是
[? ]
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1mol KClO3参加反应,有2 mol电子转移
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列物质的应用不涉及氧化还原反应的是
A.用稀硝酸洗去附在试管内壁的银镜
B.用热的纯碱溶液清洗油污
C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病
D.在铁质镀件上镀铜
参考答案:B
本题解析:稀硝酸具有氢氧化性,能氧化或腐蚀氢后不活泼金属,即3Ag+4HNO3=3AgNO3+NO↑+2H2O,因此可用稀硝酸洗涤银镜,涉及氧化还原反应,故A选项错误;纯碱为碳酸钠,Na2CO3属于强碱弱酸盐,能水解,其溶液呈碱性,且其水解反应是吸热反应,热的纯碱溶液碱性增强,能促进油脂水解且使反应速率加快,但上述变化不涉及氧化还原反应,故B选项正确;虽然新制氢氧化铜悬浊液是弱氧化剂,但能氧化葡萄糖,二者混合加热时生成砖红色沉淀,涉及氧化还原反应,故C选项错误;电镀铜时,纯铜作阳极,发生氧化反应,铁质镀件作阴极,铜盐溶液为电镀液,铜离子移向阴极并在阴极上得到电子,发生还原反应,析出铜覆盖在铁质镀件上,因此涉及氧化还原反应,故D选项错误。
本题难度:简单
4、选择题 标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g。则下列关于该过程的推断不正确的是
A.混合气体中氯气物质的量为0.04 mol
B.混合气体中SO2物质的量为0.04 mol
C.所得的沉淀为0.1 mol BaSO4
D.a的取值范围为1.344< a <1.792
参考答案:A
本题解析:将a L SO2和Cl2组成的混合气体通入100 mL 0.2 mol·L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。主要发生了:1、二氧化硫与氯气在水溶液中的氧化还原反应且两者按物质的量之比1:1进行;2、由于溶液的棕黄色变浅,知前者反应物二氧化硫过量继而发生了二氧化硫与三价铁离子的氧化还原反应,且二者按物质的量之比1:2进行。再据向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3 g,知沉淀为硫酸钡且是 =0.1摩尔,故C正确;同时知溶液中硫酸根总量为0.1摩尔,其中来自于硫酸铁0.06摩尔,那么另外0.04摩尔硫酸根肯定来自于二氧化硫的氧化产物,由此推知有0.04摩尔二氧化硫被氧化,故B正确;当溶液中所有的三价铁离子全部被还原时,(即0.04摩尔三价铁)需要二氧化硫0.02摩尔,那么其余0.02摩尔二氧化硫参与了和氯气的反应,并消耗氯气0.02摩尔,故A错误;这样看来a L混合气体的物质的量为0.08mol时,即1.792升时反应恰好完成,只要二氧化硫大于0.06摩尔即混合气体体积大于1.344升时即合题意,D正确。
=0.1摩尔,故C正确;同时知溶液中硫酸根总量为0.1摩尔,其中来自于硫酸铁0.06摩尔,那么另外0.04摩尔硫酸根肯定来自于二氧化硫的氧化产物,由此推知有0.04摩尔二氧化硫被氧化,故B正确;当溶液中所有的三价铁离子全部被还原时,(即0.04摩尔三价铁)需要二氧化硫0.02摩尔,那么其余0.02摩尔二氧化硫参与了和氯气的反应,并消耗氯气0.02摩尔,故A错误;这样看来a L混合气体的物质的量为0.08mol时,即1.792升时反应恰好完成,只要二氧化硫大于0.06摩尔即混合气体体积大于1.344升时即合题意,D正确。
本题难度:一般
5、实验题
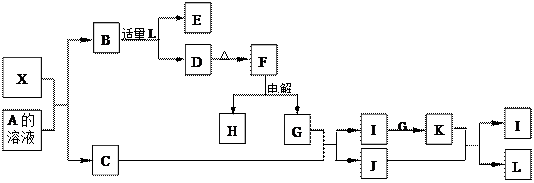 (12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。后来扩展为“等电子原理”,即等电子体的结构相似、物理性质相近。该原理常被用来发现或者合成具有特殊功能的晶体和有机物等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性;E溶液的焰色反应中呈黄色火焰。回答以下问题:
(1)写出X的化学式:________,X属于________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:____________________?__________;
写出K与J反应的化学方程式:____________________________?_____。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。?+2N2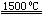 4X+SiC+3C。
4X+SiC+3C。
参考答案:(1)AlN(2分),原子(2分);
(2)AlN+NaOH+H?2O=NaAlO2+NH3↑(3分),3NO2?+H2O=2HNO3+NO(3分)
(3)Al4SiC4(2分)
本题解析:(1)由题意“X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近”知,X与碳化硅(SiC)是等电子体,电子数目为20。又由“C是一种能使湿润的红色石蕊试纸变蓝的无色气体;D为白色沉淀且具有两性”可知C为NH3,D为Al(OH)3;则F为Al2O3,G为O2,I为NO,J为H2O,K为NO2,L为HNO3 ;又“E溶液的焰色反应中呈黄色火焰”,则B必为NaAlO2,A为NaOH,X就为AlN,通过电子数为20可以进一步得到确证。
(2)略
(3)由质量守恒定律可求出方框中填新物质的化学式为:Al4SiC4
本题难度:简单