1、选择题 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
[? ]
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
参考答案:BC
本题解析:
本题难度:一般
2、选择题 有A、B、C、D四种一元酸溶液,对它们进行的有关实验及其结果分别为:(1)在物质的量浓度相同的A、C两溶液中,都滴加几滴甲基橙时,A溶液呈黄色,C溶液呈橙色(2)B的钠盐溶液的pH值小于C的钠盐溶液的pH值(3)A酸与D的盐反应生成易溶于水的A的盐和D酸。由此可以确定这四种酸的酸性由强到弱的正确排列顺序为
A.B>C>A>D? B.A>C>B>D C.D>A>C>B? D.C>B>A>D
参考答案:A
本题解析:甲基橙的变色范围是3.1~4.4,所以根据A溶液呈黄色,C溶液呈橙色可知,A的酸性弱于C的。酸越弱,相应的钠盐越容易水解,所以根据(2)可知,B的酸性强于C的。根据较强的酸制取较弱的酸可知,A的酸性强于D的,所以答案选A。
本题难度:一般
3、填空题 (4分)判断下列说法是否正确(正确的在括号内打“√”错误的打“×”)
①中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠少于醋酸;( )
②将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的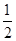 ;( )
;( )
③如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍;( )
④物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO3-4量相同。( )
参考答案:?× ?× ?× ?×
本题解析:
试题解析:?中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需氢氧化钠一样多,故错误;?将氢氧化钠溶液和氨水各稀释一倍,氢氧化钠 c(OH-)减少到原来的一半,但是随着溶液变稀,氨水的电离度增大,因此稀释后的氨水c(OH-)大于原来的一半,故错误;?如果盐酸的物质的量浓度是醋酸的二倍,由于醋酸是弱酸,则盐酸的c(H+)与醋酸c(H+)之比大于2,故错误;?磷酸钠是强电解质,在溶液中完全电离,磷酸是弱电解质,在溶液中微弱电离,磷酸钠溶液中磷酸根浓度大,故错误。
考点:弱电解质的电离
本题难度:一般
4、选择题 在相同温度下,100mL 0.1mol·L-1的醋酸与10mL 1mol·L-1的醋酸相比较,下列说法正确的是
A.溶液中H+的物质的量前者大于后者
B.前者的电离程度小于后者
C.发生中和反应时所需NaOH的量前者大于后者
D.溶液中CH3COOH的物质的量前者大于后者
参考答案:A
本题解析:由数据可计算前后溶液所含溶质的物质的量均为0.01mol,所以中和所需NaOH的物质的量相等,同时根据平衡理论,浓度越稀电离程度越大,即发生电离的溶质醋酸物质的量越大,电离出的醋酸根离子的物质的量越大,故选A。
本题难度:一般
5、填空题 某化学兴趣小组研究草酸(乙二酸,HOOC-COOH)的性质,他们查找了相关数据。
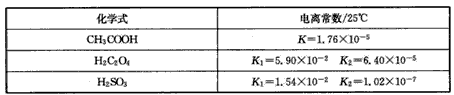
(1)0.1mol/L的CH3COOH、H2C2O4、H2SO3溶液pH最小的是____,最大的是___。
(2)KHSO3的溶液呈酸性,表明HSO3-的电离___水解(填“强于”、“弱手”或“等于”)。
(3)0.1mol/L的H2C2O4溶液与0.1mol/L NaOH溶液等体积混合,溶液的pH=a(溶液的体积等于混合前体积和)。
①则a___7(选填“>”、“<”、“=”或“不确定”);
②c(HC2O4-)+2c(C2O42-)=___(用含a的代数式表示)。
参考答案:(1)H2C2O4 ;CH3COOH
(2)强于
(3)①< ;②0.05+10-a-10-14+a
本题解析:
本题难度:一般