| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《弱电解质电离平衡》高频试题特训(2019年最新版)(一)
2、选择题 现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 C.分别加水稀释10倍、四种溶液的pH:①>②>③>④ D.将①、④两种溶液等体积混合,所得溶液中:c(NH+4)>c(SO2-4)>c(OH-)>c(H+) 3、选择题 能够说明氨水是弱碱的事实是 ( ) |
4、填空题 现有浓度均为0.1mol?L-1的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸氢铵.⑦氨水,请回答下列问题:
(1)①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)______.
(2)④.⑤.⑥.⑦四种溶液中NH4+浓度由大到小的顺序是(填序号)______.
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是______.
(4)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)______25℃.
5、选择题 下列说法正确的是
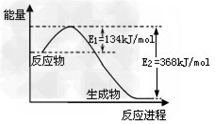
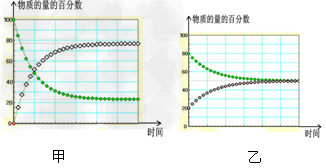
[? ]
A.?已知1?mol?NO2和1?mol?CO反应生成CO2和NO过程中能量变化如图,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=?+234kJ/mol ?
B.?一定温度下,利用pH计测定不同浓度醋酸溶液的pH 值,得到数据(如上表)
当醋酸浓度为0.1mol/L时,通过计算求得该温度下醋酸的电离度为1%
C.?已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为?5.6×10-5?mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为?5×10-5mol/L
D.?在不同条件下进行的异构化反应?X Y?的进程图解。图中的“
Y?的进程图解。图中的“ ”是X,“
”是X,“ ”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小
”是Y 则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质结构与.. | |