1、推断题 有A,B,C,D4种元素,A的正二价离子与Ar的电子层结构相同,B有3个电子层,其单质为双原子分子,
c的核外电子比A少1个,D与B在点燃和光照条件下均能化合成一种气体,它溶于水成为强酸。
(1)写出A,B,C,D的离子符号:_______________;
(2)用电子式表示这4种元素的原子形成离子化合物的过程:___________________________。
参考答案:(1)A:Ca2+,B:Cl-,C:K+,D:H+
(2)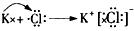 ;
;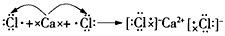
本题解析:
本题难度:一般
2、选择题 下列有关元素周期表(律)说法正确的是
A.最外层有两个电子的原子一定在IIA 族
B.IA族均为碱金属
C.同一周期核电荷数越大原子半径越大
D.同一主族金属元素核电荷数越大元素金属性越强
参考答案:D
本题解析:A不正确,例如He的最外层电子数是2,属于0族。B不正确,氢元素位于第IA,是非金属。同周期自左向右原子半径逐渐减小,C不正确。同主族自上而下金属性逐渐增强,D正确,所以正确的答案是D。
本题难度:困难
3、填空题 (1)图表法、图像法是常用的科学研究方法。短周期某主族元素M的电离能情况如图甲所示。则 M元素位于周期表的第____族。

图乙是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:____(填“a”或“b”),理由是:________。
(2)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
①Ti元素的基态原子的价电子层排布式为____;
②在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的。则绿色晶体配合物的化学式为____。
参考答案:(1)ⅢA; ⅣA ;b ;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其他氢化物的沸点不会高于水
(2)
①3d24s2 ;
②[TiCl(H2O)5]Cl2·H2O
本题解析:
本题难度:一般
4、选择题 下列说法错误的是
[? ]
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都属于金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
参考答案:A
本题解析:
本题难度:简单
5、填空题 在元素周期表第3周期中,置换酸中氢的能力最强的元素的元素符号为______,化学性质最稳定的元素符号是______,最高价氧化物的水化物的酸性最强的化合物的化学式是______,碱性最强的化合物的化学式是______,显两性的氢氧化物的化学式是______,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为______、______,原子半径最大的金属元素的名称是______,离子半径最小的离子结构示意图是______.
参考答案:同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,
则置换酸中氢的能力最强的元素为金属性最强的元素为Na;碱性最强的化合物为NaOH;
化学性质最稳定的元素为0族元素,第三周期元素为Ar;
最高价氧化物的水化物的酸性最强的化合物对应的元素为Cl元素,对应的酸为HClO4;
第三周期中的两性氢氧化物为Al(OH)3;
与盐酸、氢氧化钠溶液分别反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O、Al(OH)3+3OH-=[Al(OH)4]-;
同周期元素从左到右元素原子半径逐渐减小,则原子半径最大的是Na;
离子半径最小的离子为Al3+,离子结构示意图是
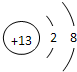
.
故答案为:Na;Ar;HClO4;NaOH;Al(OH)3;Al(OH)3+3H+=Al3++3H2O、Al(OH)3+3OH-=[Al(OH)4]-;钠;
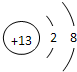
.
本题解析:
本题难度:一般