1、选择题 19世纪门捷列夫的突出贡献是( )
A.提出了原子学说
B.发现了元素周期律
C.发现了稀有气体
D.提出了分子学说
2、选择题 下列为元素周期表中的一部分,表中数字为原子序数,M的原子序数为37的是
[? ]
A.
B.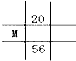
C.
D.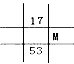
3、填空题 下表为元素周期表的一部分,请回答有关问题:

(1)⑤和⑧的元素符号是_______ 和_______,
(2)表中最活泼的金属是___________ ,非金属最强的元素是__________ ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是____,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:________,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:______________________________________。
4、选择题 X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的三倍.下列有关叙述正确的是
A.X、Y、Z三种元素可形成化合物X3YZ4
B.X、Y两元素形成的化合物只可能为离子晶体
C.Y、Z两元素形成的化合物熔点较低
D.氢化物的稳定性:Y﹥Z
5、选择题 元素周期律和元素周期表,揭示了元素之间的内在联系,反映了元素性质与其原子结构的关系,在哲学、自然科学、生产实践各方面都有重要的意义.例如人们可以根据元素周期律,在元素周期表中金属元素与非金属元素分界线附近寻找
A.耐高温的合金材料
B.制农药的元素
C.作催化剂的元素
D.作半导体材料的元素