1、实验题 (共11分) 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
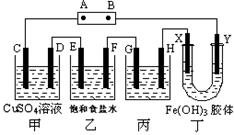
(1)电源A 极的名称是___________
(2)乙装置中电解反应的总化学方程式是________________
(3)如果收集甲、乙装置中C、D、E、F产生的物质的物质的量之比是________
(4)欲用丙装置给铜镀银,G应该是_____(填名称),电镀液的主要成分是______(填化学式)
(5)装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带_________电荷。
(6)从Cu2+、Na+、SO42-、Cl-四种离子中恰当地组成电解质,按下列要求进行电解,
写出所有符合要求的物质化学式。
①、以石墨为电极进行电解,使电解质质量减少,水质量不变,采用的电解质是________
②、以石墨为电极进行电解,使电解质质量不变,水质量减少,采用的电解质是________
③、以碳棒为阳极,铁棒为阴极进行电解,使电解质和水的质量都减少,采用的电解质是___
参考答案:(1)正极 (1分)(2)2NaCl+2H2O  2NaOH+H2 ↑+Cl2↑(2分)
2NaOH+H2 ↑+Cl2↑(2分)
(3)1:2:2:2 (2分)(4)银? AgNO3 (2分)(5) 正(1分)
(6)①CuCl2?②Na2SO4?③NaCl、CuSO4(3分,少一个0分)
本题解析:考查电化学的应用。
(1)向乙中滴入酚酞试液,在F极附近显红色,说明F电极是阴极,则E是阳极、D是阴极、C是阳极,所以A是正极,B是负极,Y是阴极,X是阳极,H是阴极,G是阳极。
(2)电极饱和食盐水的生成物是氯气、氢气和氢氧化钠,反应式为2NaCl+2H2O 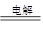 2NaOH+H2 ↑+Cl2↑。
2NaOH+H2 ↑+Cl2↑。
(3)甲中C电极产生氧气,D产生铜,E生成氯气,F生成氢气。根据电子得失守恒可知产生的物质的物质的量之比是1:2:2:2。
(4)电镀是镀层金属作阳极,待镀金属作阴极,用含有镀层金属离子的溶液作电解质溶液。G是阳极,所以G应该是银,电镀液的主要成分是硝酸银。
(5)Y电极是阴极,而Y极附近红褐色变深,说明氢氧化铁胶体向阴极移动,所以胶粒带正电荷。
(6)①属于电解电解质自身的,所以是氯化铜。②是电解水的,则为硫酸钠。③是既电解电解质自身,还电解水,所以是氯化钠或硫酸铜。
本题难度:一般
2、选择题 用阳极X和阴极Y电解N的水溶液,通电一段时间后仍为N溶液,再加入M,电解液N能恢复到电解前状态的是:
| 组号 | X | Y | N | M
A
C
Fe
KCl
盐酸
B
Pt
Cu
CuSO4
Cu(OH)2
C
C
Cu
H2SO4
H2O
D
Ag
C
AgNO3
AgNO3固体
|
( )
A.A
B.B
C.C
D.D
参考答案:A、以Fe和C为电极,电解氯化钾,阳极氯离子放电,阴极氢离子放电,通电一段时间后为氢氧化钾溶液,故A错误;
B、以Pt和Cu为电极,电解硫酸铜,阳极氢氧根离子放电,阴极铜离子放电,通电一段时间后为硫酸溶液,故B错误;
C、以C和Cu为电极,电解硫酸,阳极氢氧根离子放电,阴极氢离子放电,相当于电解水,通电一段时间后仍为硫酸溶液,可以加水让溶液复原,故C正确;
D、以Ag和C为电极,电解AgNO3,阳极银离子放电,阴极银离子放电,相当于电镀,通电一段时间后仍为AgNO3溶液,且浓度不变,不需要加AgNO3固体恢复原样,故D错误.
故选C.
本题解析:
本题难度:简单
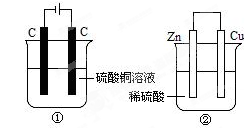
3、选择题 下图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5 mol·L-1,工作一段时间后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是?
 ?
?
A.产生气体体积 ①<②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑
D.溶液的pH变化:①减小,②增大
参考答案:AD
本题解析:
分析:根据电池的工作原理写出电极反应,在两极上,得失电子数相等,可以根据电子守恒来进行相关的计算.
解:A、①是电解池,电极反应为:阳极:4OH-→O2↑+2H2O+4e-,阴极:Cu2++2e-→Cu,②是原电池,正极反应:2H++2e-→H2,负极反应:Zn+2e-→Zn2+,液体体积均为200mL,浓度均为0.5mol/L,所以硫酸铜、硫酸的物质的量均为0.1mol,当有0.02mol的电子通过时,①产生的气体是氧气,为0.005mol,②中0.01mol氢气放出,所以①<¬②,故A正确;
B、①中阴极反应:Cu2++2e-→Cu,阴极质量增加,②中正极反应:2H++2e-→H2,正极质量不变,故B错误;
C、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:Zn+2e-→Zn2+,故C错误;
D、溶液的pH变化:①中消耗氢氧根,所以碱性减弱pH减小,②中消耗氢离子,所以酸性减弱pH增大,故D正确.
故选AD.
本题难度:简单
4、选择题 用石墨作电极电解AlCl3溶液时,下图的电解过程变化曲线合理的是
[? ]
A.
B.? 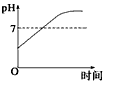
C.? 
D.? 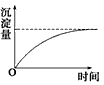
参考答案:D
本题解析:
本题难度:一般
5、填空题 (10分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O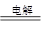 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
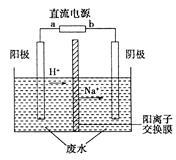
(1)若以锌锰碱性电池为直流电源,该电池总反应式为:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。该电池的a电极的电极反应式为:_____________________________________________。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应式如下:
阳极:①4OH--4e-===O2↑+2H2O。
②_______________________________________________。
阴极:①__________________________________________。
②CH3CHO+2e-+2H2O===CH3CH2OH+2OH-。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
b.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
c.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
参考答案: (1) 2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(2分)
(2)②CH3CHO-2e-+H2O=CH3COOH+2H+(2分)
①4H++4e-=2H2↑或2H++2e-=H2↑或4H2O+4e-=2H2↑+4OH-(2分)
(3)ac(2分) (5)分馏或蒸馏 (2分)
本题解析:(1)a电极与电解池的阳极相连,这说明a是正极。根据电池总反应式Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2可正极是二氧化锰得到电子,则该电池的a电极的电极反应式为2MnO2+2H2O+2e-=2MnO(OH)+2OH-。
(2)电解池中阳极失去电子,除了氢氧根放电外,乙醛失去电子转化为乙酸,反应的电极反应式外CH3CHO-2e-+H2O=CH3COOH+2H+;阴极得到电子,除了乙醛得到电子转化为乙醇以外,溶液中的氢离子也得到电子转化为氢气,电极反应式为2H++2e-=H2↑。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.根据物料守恒可知c(Na+)=2c(CH3COOH)+2c(CH3COO-),a正确;b.根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-)可知c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)是错误的,b不正确;c.醋酸是一元弱酸,电离常数小,则溶液中c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),c正确,答案选ac。
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃,由于二者互溶,所以从电解后阴极区的溶液中分离出乙醇粗品的方法是蒸馏。
考点:考查电化学原理的应用、溶液中离子浓度比较以及物质的分离与提纯
本题难度:困难