1、选择题 等温、等压、等质量的气体:H2、D2、T2,下列叙述中正确的是 (?)
①密度之比为l︰2︰3?②质子数之比为6︰3︰2
③中子数之比为0︰3︰4?④体积之比为6︰3︰2
A.①②③④
B.②③④
C.①②
D.③④
参考答案:A
本题解析:略
本题难度:简单
2、选择题 X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如右下表。已知:X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素。下列说法错误的是?(?)
X
| ?
| ?
| 
| ?
|
?
| ?
| Z
| ?
| ?
|
?
A.X和氢组成的化合物分子中可能含有极性共价键和非极性共价键
B.工业上用电解Y和W组成的化合物来制备Y
C.Z、W两元素的气态氢化物中,W的气态氢化物更稳定
D.X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4
参考答案:B
本题解析:略
本题难度:一般
3、填空题 下表是元素周期表的一部分,按要求填空:
族
周期
| IA
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| 0
|
2
| ?
| ?
| ?
| ?
| ①
| ?
| ②
| ?
|
3
| ③
| ④
| ⑤
| ⑥
| ?
| ⑦
| ⑧
| ⑨
|
4
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)写出下列元素的元素符号:①? _______ ②_______? _?_______?
(2)写出下列元素的名称,最活泼的金属元素是__ ___,最活泼的非金属元素是?____ ,
(3)用化学式表示在这些元素的最高价氧化物对应水化物中,酸性最强的是?,
碱性最强的是?,呈两性的氢氧化物是?。
(4)在③与④的单质中,用元素符号表示化学性质较活泼的是?,实验验证方法是?;在⑧与?的单质中,用元素符号表示化学性质较为活泼的是?,实验验证的方法是?
参考答案:(12分每空1分)?(1)N;F;Ca (2)钾;氟(3)HClO4;KOH;Al(OH)3
(4)Na;钠与冷水剧烈反应,而镁与冷水几乎不反应;
Cl2;氯气可以与溴化钾反应,置换出单质溴
本题解析:(1)根据元素在周期表中的相对位置可知,①、②、?的元素符号分别是N、F、Ca。
(2)同周期自左向右金属性逐渐降低,非金属性逐渐增强。同主族自上而下,金属性逐渐增强,非金属性逐渐降低,所以最活泼的金属元素是钾,最活泼的非金属元素是氟。
(3)非金属性或金属性越强,最高价氧化物的水化物的酸性或碱性越强,则最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3。
(4)同周期自左向右金属性逐渐降低,非金属性逐渐增强,据此可知在③与④的单质中,化学性质较活泼的是Na。一般情况下,与水反应越容易、越剧烈,其金属性越强。由于钠与冷水剧烈反应,而镁与冷水几乎不反应,据此可知钠比镁活泼;同主族自上而下,金属性逐渐增强,非金属性逐渐降低,所以在⑧与?的单质中,化学性质较为活泼的是氯气。由于较活泼的非金属单质能置换出较不活泼的非金属单质,即氯气可以与溴化钾反应,置换出单质溴,所以氯气的化学性质比单质溴活泼。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
4、填空题 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
族周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ⑧
| ⑨
| ?
|
(1)画出表中形成化合物种类最多元素的原子结构示意图?;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式_________,用电子式表示⑤和⑧形成化合物的过程________________________________________。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为____(填化学式)。
(3)⑤和⑨形成化合物的晶体类型为__________。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式__________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为?,写出X溶液与小苏打反应的化学方程式为_______________。
参考答案:(1) (1分);
(1分);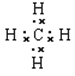 (1分);
(1分);
 (1分);
(1分);
(2)S2->O2->Na+(1分);HClO4>HNO3>H2SiO3(1分)?(3)离子晶体(1分)
(4)Al2O3(1分) ;Al2O3+2OH-=2AlO- 2+H2O(2分)
(5)甲酸(1分);HCOOH+NaHCO3= HCOONa +CO2↑+H2O(2分)
本题解析:根据元素①~⑨在表中的位置可知,它们分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)形成化合物种类最多元素是碳元素,碳元素的原子序数是6,其原子结构示意图为 ;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为
;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为 ;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为
;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为 。
。
(2)④⑤⑧形成的简单离子分别是O2-、Na+、S2-,离子的核外电子层数越多离子半径越大。核外电子排布相同的微粒其离子半径随原子序数的增大而减小,所以④⑤⑧形成的简单离子半径由大到小的顺序是S2->O2->Na+。非金属性越强,最高价氧化物对应水化物的酸性越强,③⑦⑨三种元素的非金属性强弱顺序是Cl>N>Si,其最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HNO3>H2SiO3。
(3)⑤和⑨形成化合物是NaCl,其晶体类型为离子晶体。
(4)不溶于水,但既能与强酸又能与强碱反应的是Al2O3。钠的最高价氧化物对应水化物是氢氧化钠,和氧化铝反应的离子方程式为Al2O3+2OH-=2AlO- 2+H2O。
(5)X的溶液能与小苏打反应产生Y,这说明X的酸性强于碳酸的。又因为X是由H、C、O元组成,如果X是其所属系列中最简单的分子,且相对分子质量为46,则X一定是甲酸,与碳酸氢纳反应的化学方程式为HCOOH+NaHCO3= HCOONa +CO2↑+H2O。
本题难度:一般
5、选择题 以下有关原子结构及元素周期律的叙述正确的是
A.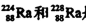 是中子数不同质子数相同的同种核素
是中子数不同质子数相同的同种核素
B.第IA族金属元素是同周期中金属性最强的元素
C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
D.短周期元素形成离子后,最外层都达到8电子稳定结构
参考答案:B
本题解析:A、这两种微粒质子数相同中子数不同,是两种核素,错误;B、正确;C、同主族非金属性从上到下减弱,其氢化物的稳定性也逐渐减弱,错误;D、氢、锂等元素形成的离子不能满足8电子稳定结构,错误。
本题难度:一般