1、选择题 下列有关物质性质的比较中,正确的是 ( )
①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl-
③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:①同周期中,氢化物的热稳定性从左到右是越来越稳定:CH4<NH3<H2O
②非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性增强:I->Br->Cl-
③不同元素的最高价含氧酸,成酸元素的非金属性越强,则酸性越强:H3PO4<H2SO4<HClO4
④原子半径从左到右逐渐减小,从上到下逐渐增大:Na>Mg>O,故只有②④正确,选B。
点评:本题考查元素周期律的相关知识,难度不大,可根据所学知识进行解答。
本题难度:简单
2、选择题 短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.W的最高价含氧酸的酸性强于Z的最高价含氧酸的酸性
D.原子半径的大小顺序: rZ>rY>rX
参考答案:A
本题解析:元素X的原子半径最小,则X为H元素;W原子的电子总数是其电子层数的5倍,则W为P元素;Z和W的原子序数相差8,则Z的原子序数是7,为N元素;根据原子序数依次增大,Y元素和X元素在一定条件下能形成YX,可知Y为Li元素。A、Li可用于制造高性能可充电电池—锂电池,正确;B、WX3为PH3,ZX3为NH3,因为NH3分子间能形成氢键,所以PH3的沸点低于NH3,错误;C、W的最高价含氧酸为H3PO4,Z的最高价含氧酸为HNO3,酸性H3PO4弱于HNO3,错误;D、原子半径的大小顺序为:rY > rZ >rX,错误。
本题难度:一般
3、填空题 A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,D和A形成简单离子后,它们的电子层相差两层,已知A处于第n族,D处于第m族,且A单质中含有共价键,B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等,C和A形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,试回答:
(1)C离子的结构示意图为?[
(2)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为?.
(3)向A、C形成的化合物的水溶液中滴入氨水,其反应的离子方程式为___________________
参考答案:
(1)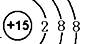

本题解析:略
本题难度:简单
4、选择题 下列有关原子结构和元素周期律的表述,正确的是(?)
①原子序数为16的元素的最高化合价为+4
②IA族元素是同周期中失电子能力最强的元素
③第2周期IVA族元素的原子核电荷数和中子数一定为6
④原子序数为13的元素位于元素周期表的第3周期III族
A.①②
B.①③
C.②④
D.③④
参考答案:C
本题解析:原子序数为16的元素是S元素,最高化合价为+6价,①不正确;同周期自左向右金属性逐渐增强,所以IA族元素是同周期中失电子能力最强的元素,②正确;第2周期IVA族元素是碳元素,其原子核电荷数一定为6,但中子数不一定是6,③不正确;原子序数为13的元素是铝元素,位于元素周期表的第3周期III族,④正确,答案选C。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题针对性强,紧扣教材,意在巩固学生的基础,提高学生的能力,难度不大。熟记元素周期表的结构和元素周期律,是答题的关键。
本题难度:一般
5、选择题 下列物质中,酸性由强到弱错误的是
A.HClO4 H2SO4 H3PO4 HSiO4
B.HClO4 HClO3 HClO2 HClO
C.H2SO4 H2SO3 HNO3 HNO2
D.HClO4H2SO4 H2SO3 H2CO3
参考答案:C
本题解析:略
本题难度:简单