1、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
[? ]
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液
D.不用铁片,改用铁粉
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列各图是温度(或压强)对应2A(s)+2B(g) 2C(g)+D(g)△H>0 的正、逆反应速率的影响,其中正确的是
2C(g)+D(g)△H>0 的正、逆反应速率的影响,其中正确的是
参考答案:C
本题解析:该反应是体积增大的、吸热的可逆反应。因此升高温度平衡向正反应方向移动,增大压强平衡向逆反应方向移动。无论平衡怎么移动,只要增大压强或升高温度,反应速率一定会增大,所以正确的答案是C。
本题难度:一般
3、选择题 下列关于化学反应速率的说法,错误的是
A.化学反应速率通常用单位时间内反应物浓度的增加量或生成物浓度的减少量来表示
B.化学反应速率的数值无负值,均为正值
C.不能用固体或纯液体的浓度变化量表示化学反应速率
D.化学反应速率的单位是mol/(L·s)或mol/(L·min)
参考答案:A
本题解析:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示,因此选项A不正确,其余都是正确的,答案选A。
点评:该题是基础性试题的考查,试题注重基础,兼顾对学生能力的培养。该题的关键是理解反应速率的含义以及表示方法,有助于巩固学生的基础知识,提高学生分析问题、解决问题的能力。
本题难度:简单
4、选择题 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示.下列说法中正确的是( )

A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(L?min)
D.30min~40min间该反应使用了催化剂
参考答案:A.由图象可知,30min时正、逆反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故C正确;
D.由A中分析可知,30min时正、逆反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故D错误;
故选:B.
本题解析:
本题难度:简单
5、填空题 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
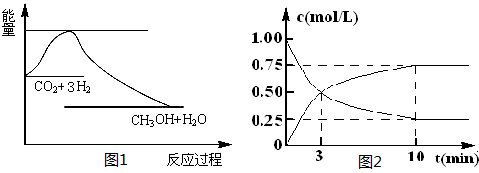
(1)关于该反应的下列说法中,正确的是 (填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有 ;其正极的电极反应式是: 。
参考答案:(17分) (1)C(2分)(2) ① 0.075 mol·L-1·min-1(2分) 56.25%(2分)
②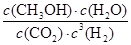 (2分) ③ BD(2分,少选得1分、多选或错选均不能得分)
(2分) ③ BD(2分,少选得1分、多选或错选均不能得分)
(3)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1(3分,单位错漏扣1分)
(4)甲醇、氢氧化钠、水(2分,漏写一个扣1分,漏写两个或错写均不得分);
O2+2H2O+4e-=4OH?(2分)
本题解析:(1)根据图1可知,该反应的反应物总能量高于生成物总能量,所以反应是放热反应,即△H<0;根据方程式可知,该反应是气体体积减小的可逆反应,因此△S<0,答案选C。
(2)①根据图2可知,反应进行到10min时,各种物质的浓度不再发生变化,反应达到平衡状态。根据图2可知,甲醇的浓度增加了0.75mol/L,所以甲醇的反应速率v(CH3OH)=0.75mol/L÷10min=0.075 mol·L-1·min-1;根据方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,所以氢气的转化率是w(H2)=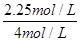 ×100%=56.25%。
×100%=56.25%。
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式K=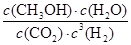 。
。
③依据化学反应的影响因素和条件逐项分析判断即可:A、反应是放热反应,升高温度平衡逆向进行;B、将CH3OH(g)及时液化抽出,减小生成物的浓度平衡正向进行;C、选择高效催化剂只能改变反应速率,不能改变化学平衡;D、再充入l molCO2和4molH2,相当于增大压强平衡正向进行;答案选BD。
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,所以1mol甲醇即32g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ×2=726.6 kJ的热量,因此该反应的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.6kJ·mol-1。
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。据此可知,该原电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;正极通入的是氧气,则正极电极反应式为O2+2H2O+4e-=4OH?。
考点:考查焓变和熵变、反应速率和转化率的计算、化学平衡常数、外界条件对平衡状态的影响、热化学方程式的书写以及燃料电池的有关判断和电极反应式的书写等
本题难度:一般