1、填空题 (12分)在一只小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4Cl晶体,并用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是___ ____。
(2)写出有关反应的化学方程式: ____ ___ ,
该反应属_______反应(填基本反应类型)。
(3)实验中观察到的现象有__ _____ 、___ ____且反应混合物成糊状,反应混合物呈糊状的原因是____ ___ 。
(4)通过___ _现象,说明该反应为_______热反应,这是由于反应物的总能量__ ___ _
生成物的总能量(填“高”或“低”)
参考答案:(1)搅拌加速反应;2分;
(2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 2分;复分解反应 2分;
(3)闻到剌激性气味、烧杯和玻璃片粘在一起(或结冰)、生成水 各1分;
(4)结冰、吸热、低 各1分;
本题解析:(1)因为这是固体与固体之间的反应,所以通过玻璃棒的搅拌可以增大接触面积,加快反应速率。
(2)强碱和铵盐可以发生复分解反应生成氨气,方程式为Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O。
(3)随着反应的进行会有氨气生成,所以能闻到刺激性气味,同时可以看见烧杯和玻璃片粘在一起。由于反应中有水生成,所以会出现糊状。
(4)之所以会结冰,是由于温度降低导致的,这说明反应是吸热反应。因此反应物的总能量低于生成物的总能量。
本题难度:一般
2、选择题 下列过程中化学键未被破坏的是( )
A.干冰升华
B.溴与H2生成HBr
C.SO2气体溶于水
D.NaCl固体溶于水
参考答案:A、干冰升华,只是状态的变化,干冰的构成微粒是分子,气态的二氧化碳构成微粒也是分子,所以化学键未被破坏,故A正确;
B、溴和氢气生成溴化氢,发生了化学反应,有化学键的破坏,故B错误;
C、二氧化硫溶于水,二氧化硫和水发生化学反应生成亚硫酸,所以有化学键的破坏,故C错误;
D、氯化钠固体溶于水,氯化钠在水分子的作用下电离出自由移动的阴阳离子,所以化学键被破坏,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 已知中和热的数值是57.3 kJ·mol
参考答案:
本题解析:
本题难度:简单
4、选择题 有关物质结构的叙述正确的是?(?)
A.有较强共价键存在的物质熔沸点一定很高
B.由电子定向移动而导电的物质是金属晶体
C.只含有共价键的物质不一定是共价化合物
D.在离子化合物中不可能存在非极性共价键
参考答案:
C
本题解析:
本题考查基本概念。物质熔沸点的强弱不一定与共价键强弱有关,如分子晶体的熔沸点与物质的相对分子质量有关,A选项错误;石墨为层状结构,每一层分都有一个大π键,大π键供这一层电子共用,能自由移动,故能导电,则石墨的导电原理也是电子定向移动,B选项错误;金刚石中只含有共价键,但为单质,C选项正确;D选项的反例是过氧化钠,存在离子键和非极性共价键,D选项错误。
本题难度:简单
5、填空题 (1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
元素
| 相关信息
|
X
| 由X形成的单质是最清洁的能源
|
Y
| 基态原子核外p能级电子总数比s能级少一个
|
Z
| 由Z形成的多种单质,其中之一是地球生物的“保护伞”
|
W
| 含量位居地壳中金属元素的第二位
|
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2与足量的Y2置于密闭容器中充分反应生成YX3,当X2的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
参考答案:(14分)
(1)二(1分)VIA(2分) [Ar]3d64s2(或1s22s22p63s23p63d64s2)(2分)
(2)大(2分)NH4NO3或NH4NO2(2分)
(3)3Fe+4H2O(g) Fe3O4+4H2 (2分)
Fe3O4+4H2 (2分)
(4)N2(g)+3H2(g)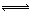 2NH3(g) ?H=—92.4kJ?mol?1 (3分)
2NH3(g) ?H=—92.4kJ?mol?1 (3分)
本题解析:由X形成的单质是最清洁的能源,则X为H元素;Y的基态原子核外p能级电子总数比s能级少一个,则Y基态原子核外电子排布为:1s22s22p3,则Y为N元素;能作为地球生物的“保护伞”的单质为O3,则Z为O元素;W的含量居地壳中金属元素的第二位,则W为Fe元素。
(1)Z为O元素,位于元素周期表第二周期第VIA族;W为Fe元素,原子序数为26,则W的基态原子核外电子排布式为:[Ar]3d64s2(或1s22s22p63s23p63d64s2)。
(2)N原子2p轨道排布了3个电子,为半充满状态,更稳定,N的第一电离能大于O的第一电离能;H、N、O元素可形成NH4NO3或NH4NO2两种盐。
(3)W元素的单质为Fe,X2 Z为H2O,Fe与水蒸气在高温条件下反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(4)首先写出N2与H2反应的化学方程式并注明状态,N2(g)+3H2(g)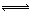 2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则?H=7.7kJ÷0.25mol×3=—92.4kJ?mol?1,可得热化学方程式。
2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则?H=7.7kJ÷0.25mol×3=—92.4kJ?mol?1,可得热化学方程式。
考点:本题考查原子结构、电子排布、第一电离能的比较、化学方程式和热化学方程式的书写。
本题难度:一般