1、简答题 (15分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号
| 室温下,试管中所加试剂及其用量 / mL
| 室温下溶液颜色褪至无色所需时间 / min
|
0.6 mol/L
H2C2O4溶液
| H2O
| 3 mol/L
稀硫酸
| 0.05mol/L KMnO4溶液
|
1
| 3.0
| 2.0
| 2.0
| 3.0
| 1.5
|
2
| 2.0
| 3.0
| 2.0
| 3.0
| 2.7
|
3
| 1.0
| 4.0
| 2.0
| 3.0
| 3.9
|
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号
| 室温下,试管中所加试剂及其用量 / mL
| 再向试管中加入少量固体
| 室温下溶液颜色褪至无色所需时间 / min
|
0.6 mol/L
H2C2O4溶液
| H2O
| 3 mol/L
稀硫酸
| 0.05 mol/L KMnO4溶液
|
4
| 3.0
| 2.0
| 2.0
| 3.0
|
| t
|
③若该小组同学提出的假设成立,应观察到的现象是 。
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为 ;总方程式为 。
2、选择题 可逆反应mA(g)  nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是
nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是
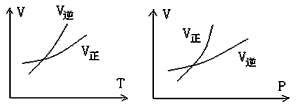
[? ]
A.m>n,正反应放热
B.m>n+p,正反应放热
C.m>n,正反应吸热
D.m<n+p,正反应吸热
3、选择题 影响化学反应速率的因素有多方面,如浓度。压强。温度。催化剂等。下列有关说法不正确的是
A.改变压强能改变气体反应的速率
B.增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数
C.温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数
D.催化剂能加快化学反应速率主要原因是降低反应所需的能量