1、选择题 氯化硼(BCl3)的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能与水反应。下列有关叙述中正确的是( )
A.氯化硼液态时能导电而固态时不导电
B.将氯化硼加到水中会使溶液的PH降低
C.氯化硼分子为三角锥形
D.氯化硼晶体为分子晶体,不溶于水
2、填空题 (22分) 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为??;1mol O22+中含有的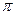 键数目为?。
键数目为?。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为?。
(3)乙炔与氢氰酸反应可得丙烯腈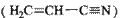 。丙烯腈分子中碳原子轨道杂化类型是??;分子中处于同一直线上的原子数目最多为?。
。丙烯腈分子中碳原子轨道杂化类型是??;分子中处于同一直线上的原子数目最多为?。
(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为??。
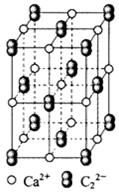
(5)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛高,其主要原因是?;甲醛分子中碳原子的轨道杂化类型为?。
②甲醛分子的空间构型是?;1mol甲醛分子中σ键的数目为?。
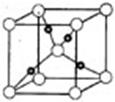
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为?。
3、填空题 (10分)铁及铁的化合物在生产、生活中有着重 要的用途。
要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04) (3-n) / 2 ]m?,现代潜水处理工艺中常利用PFS在水体中形成絮状物 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__?个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__?个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____? ?____ 。
?____ 。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____?___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______?晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____?___。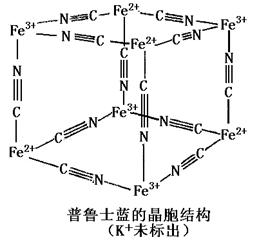
4、选择题 下列各组微粒的化学式中能真实表示分子组成的是(?)
A.NaCl
B.SiO2
C.Si
D.P4
5、填空题 附加题(1)石墨晶体的层状结 构,层内为平面正六边形结构(如图a),试回答下列问题:图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个,碳原子数目与碳碳化学键数目之比为_______。
构,层内为平面正六边形结构(如图a),试回答下列问题:图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个,碳原子数目与碳碳化学键数目之比为_______。
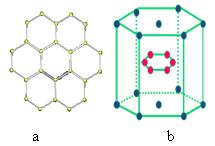
(2)2001年报道的硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图 b所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为______
b所示的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为______ _。
_。