1、选择题 下列叙述,能肯定判断某化学平衡发生移动的是
A.混合物中各组分的浓度改变
B.混合物的密度改变
C.正、逆反应速率改变
D.反应物的转化率改变
2、填空题 (9分)(1)已知:N N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式?;
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式?;
该反应的熵变△S?0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为?。
②当温度由T1变化到T2 (T2 >T1)时(如图),平衡常数KA?KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较,?(填化学式)的物质的量增加。
3、选择题 一定条件下,对于可逆反应:X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol ·L-1、0.08 mol ·L-1,则下列判断正确的是?
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol ·L-1、0.08 mol ·L-1,则下列判断正确的是?
[? ]
A.c1∶c2=1∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为1:3
D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
4、选择题 工业制硫酸中的一步重要反应是SO2在400~500℃下催化氧化,2SO2+O2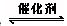 2SO3?,这是一个正反应放热的可逆反应。下列有关说法中错误的是()
2SO3?,这是一个正反应放热的可逆反应。下列有关说法中错误的是()
A.使用催化剂是为了加快反应速率,提高生产效率
B.上述条件下,SO2不可能100%转化为SO3;
C.达到平衡状态时,SO2浓度与SO3浓度相等
D.达到平衡状态时,SO2的消耗速率与SO2的生成速率相等
5、选择题 在容积为2L的密闭容器中,有反应: mA(g)+nB(g) pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为:A减少amol/L,C增加2a/3mol/L,B的平均反应速率VB=a/15mol/(L·min),这时若增加体系压强,发现A与C的百分含量不变,则m:n:p:q为
pC(g)+qD(g),经过5分钟达到平衡,此时各物质的变化为:A减少amol/L,C增加2a/3mol/L,B的平均反应速率VB=a/15mol/(L·min),这时若增加体系压强,发现A与C的百分含量不变,则m:n:p:q为
[? ]
A.3:1:2:2
B.1:3:2:2
C.1:3:2:1
D.1:1:1:1