1、选择题 已知25℃时,下列物质的电离常数大小顺序为:H2SO3(一级电离)>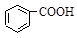 >HSO3->
>HSO3->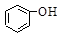 水杨酸(
水杨酸(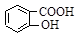 )与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
)与亚硫酸钠溶液反应,可能发生反应的离子方程式书写正确的是
A.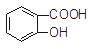 + SO32―→
+ SO32―→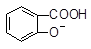 + HSO3―
+ HSO3―
B.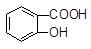 + SO32―→
+ SO32―→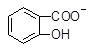 +HSO3―
+HSO3―
C.2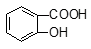 + SO32―→2
+ SO32―→2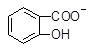 +SO2↑+H2O
+SO2↑+H2O
D.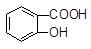 +2SO32―→
+2SO32―→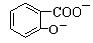 +2HSO3―
+2HSO3―
参考答案:B
本题解析:根据电离常数大小顺序A中应该是羧基失去氢离子,产物中应该生成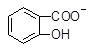 + HSO3―错误。B正确。C由于电离常数 H2SO3(一级电离)>
+ HSO3―错误。B正确。C由于电离常数 H2SO3(一级电离)>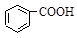 故不可能生成SO2,错误。D正确的写法应该是
故不可能生成SO2,错误。D正确的写法应该是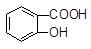 +SO32―→
+SO32―→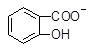 + HSO3―,错误。
+ HSO3―,错误。
本题难度:一般
2、填空题 (1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b___________;
②若所得混合液的pH=2,则a∶b___________;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值________7,混和前c(NH3·H2O)________c(HCl),氨水中c(OH-)________盐酸中c(H+)。(填>、<或=,下同)
参考答案:(1)10∶1;9∶2
(2)=;>;<
本题解析:
本题难度:一般
3、选择题 关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
A.取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸
C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多
D.两种酸溶液中c(CH3COO-)=c(Cl-)
参考答案:B
本题解析:考查弱电解质的电离平衡
A:两溶液稀释相同倍数时,由于促进了弱酸的电离平衡,可电离出部分氢离子,醋酸的pH将小于盐酸,故为保证pH相同,醋酸稀释倍数应相对较大,正确
B:开始反应是两溶液的氢离子浓度相同,反应速率也应该相同,不正确
C:由于在中和过程中,醋酸可不断电离出氢离子,故醋酸消耗的碱相对多,正确
D:两溶液中分别存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)、c(Cl-)+c(OH-)=c(H+),由于两溶液的pH相同,可得出c(CH3COO-)=c(Cl-),正确
答案为B
本题难度:简单
4、选择题 室温下pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
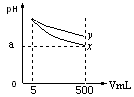
A.稀释后x溶液中水的电离程度比y溶液中水电离程度小
B.若x、y是一元碱,室温下pH=11的x、y两种碱溶液的浓度相同
C.若x、y都是弱碱,则a的值一定大于9
D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y)