|
高中化学知识点总结《物质组成与性质实验方案的设计》考点巩固(2019年最新版)(八)
2020-07-07 23:49:59
【 大 中 小】
|
1、实验题 (12分)实验室欲配制250mL 0.2 mol·L-1的碳酸钠溶液,回答下列问题:
可供选择的仪器:①量筒②胶头滴管③托盘天平④药匙⑤烧瓶⑥烧杯
(1)通过计算可知,应用托盘天平称取?g碳酸钠晶体(Na2CO3?10H2O)。
(2)配制过程需要的仪器__________________ ______(填序号),还缺少的仪器有?。 ______(填序号),还缺少的仪器有?。
(3)配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)_____________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.用托盘天平准确称取所需的Na2CO3?10H2O晶体的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
| E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作______________;若定容时俯视刻度线_______________。
参考答案:(12 分)每空2分 分)每空2分
(1) 14.3
(2)②③④⑥ (①可有可无);? 250mL容量瓶,玻璃棒
(3)BCAFED
(4)偏低;偏高
本题解析:略
本题难度:一般
2、实验题 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原性铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
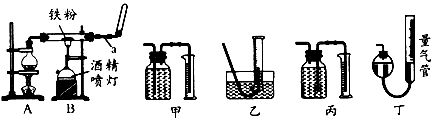
(1)仪器a的名称是________;烧瓶中所放的固体是____________。
(2)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成的气体的体积,计算铁粉的转化率。
①该同学应该先点燃____(填“A”或“B”,下同)处的酒精灯(或酒精喷灯),一段时间后,再点燃
____ 处的酒精灯(或酒精喷灯);测量气体体积不可以选用上图中的____(填“甲”“乙…"丙”或“丁”)装置;
②称取1.0g 铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为44.8
mL,则铁粉的转化率为________。
(3)为了分析反应后的固体混合物中是否含有+3价的Fe,该同学将反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色。请你在下表中将该同学滴加KSCN溶液后观察到的现象补充完整,并写出相应的结论与解释。

参考答案:(1)球形干燥管或干燥管碎瓷片;沸石或碎玻璃片
(2)①A;B;甲;② 8.4%
(3)不变;能;①Fe3O4 +8H+ = Fe2+ +2Fe3+ +4H2O;②Fe + 2Fe3+ = 3Fe2+
本题解析:
本题难度:一般
3、填空题 (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO4?5H2O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______.
参考答案:(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO4?5H2O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO4?5H2O.
故反应方程式为第一步:2Cu+O2?△?.?2CuO;
第二步:CuO+H2SO4=CuSO4+H2O;
第三步:CuSO4+5H2O=CuSO4?5H2O.
故答案为:2Cu+O2=2CuO;CuO+H2SO4=CuSO4+H2O;CuSO4+5H2O=CuSO4?5H2O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
故答案为:2Cu+O2+2H2SO4?△?.?2CuSO4+2H2O.
本题解析:
本题难度:一般
4、实验题 下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。

图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器为_____________(填仪器或某部位的代号) 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。 D处使用碱石灰的作用是
______________________。
(3)检验乙醇氧化产物时F中的实验现象是_______________________。
(4)E处是一种纯净物,其反应方程式为_______________________。
(5)写出乙醇发生催化氧化的化学方程式_______________________。
参考答案:(1)EABF
(2)水浴加热;防止F中的水蒸气进入C中与无水CuSO4作用,影响产物水的检验
(3)F中产生红色沉淀
(4)2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑
(5)2CH3CH2OH+O2→2CH3CHO+2H2O
本题解析:
本题难度:一般
5、实验题 ?乙二酸(H2C2O4)俗名草酸,草酸易溶于水,市售消字灵一般为高锰酸钾和草酸的混合溶液。
(1) 在KMnO4与H2C2O4反应中,可通过测定____________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:_______________?_____________;
(2) 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,H2C2O4水溶液可以用酸性KMnO4溶液进行滴定
该组同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③已知用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,逐滴加入到装有草酸溶液的锥形瓶中,到滴定终点时,停止滴定。开始时读数及恰好反应时KMnO4溶液的读数见下表。
实验编号
| 待测草酸溶液体积(mL)
| 滴定开始读数(mL)
| 滴定结束读数(mL)
| ①
| 25.00
| 0.00
| 10.00 m
| ②
| 25.00
| 1.00
| 11.02
| ③
| 25.00
| 0.22
| 12.00
|
请回答:滴定时,将KMnO4标准液装在?(填“酸式滴定管”或“碱式滴定管”)中。
请在下面空白处通过上述数据,计算出待测的草酸的物质的量浓度?mol/L。计算出x=?。若滴定终点时俯视滴定管刻度,则由此测得的x值会?;若滴定后,滴定关尖嘴处有气泡,则由此测得的x值会?。填“偏大”、“偏小”或“不变”)。
参考答案:
(10分)
(1)溶液褪色所需时间;(1分)
2MnO4- + 5H2C2O4 + 6H+?= 2Mn2+ + 8H2O +10CO2↑(2分)
(2)酸式滴定管 (1分)?0.1000?,x=" 2?" (各2分)?偏大,偏小(各1分)
本题解析:略
本题难度:简单
| 