1、实验题 镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下
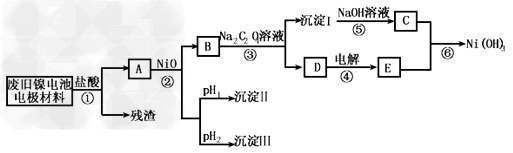
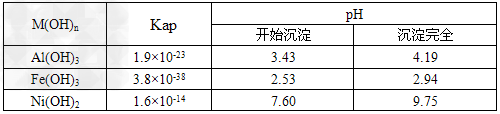
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+ ? ②某温度下一些金属氢氧化物的Kap及沉淀析出的理论pH如下表所示
回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ________和沉淀Ⅲ_________(填化学式),则pH1________pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用_____。
A.pH试纸 B.石蕊指示剂?C.pH计
(2)已知溶解度:NiC2O4·H2O>NiC2O4·2H2O,则③的化学方程式是______________。第③步反应后,过滤沉淀嘶需的玻璃仪器有_____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因______________、______________?。
(3)④中阳极反应产生的气体E为____________,验证该气体的试剂为______________。
(4)试写出⑥的离子方程式_____________________。?
参考答案:(1)Fe(OH)3;Al(OH)3;<;C
(2)NiCl2 + Na2C2O4 + 2H2O = NiC2O4·2H2O↓ + 2NaCl;漏斗、玻璃棒、烧杯;玻璃棒划破滤纸;滤液超过滤纸边缘
(3)Cl2;淀粉碘化钾溶液
(4)2Ni(OH)2 + 2OH- + Cl2 = 2Ni(OH)3+ 2Cl-
本题解析:
本题难度:一般
2、填空题 为检验某碳酸钠溶液中混有的溴化钠,进行如下实验:
| 实验步骤 | 实验现象 | 简答
取样,加入过量的稀硝酸
加硝酸的目的是:______
加入硝酸银溶液
反应的化学方程式为:______
参考答案:加入硝酸,碳酸钠与硝酸反应生成二氧化碳气体,可观察到有大量气泡生成,可除去溶液中的CO32-离子,防止碳酸钠对溴化钠检验的干扰;
然后加入硝酸银溶液,可生成浅黄色AgBr沉淀,反应的化学方程式为AgNO3+NaBr=AgBr↓+NaNO3,
故答案为:实验步骤实验现象简 答取样,加入过量的稀硝酸产生大量气泡除去CO32-,防止碳酸钠对溴化钠检验的干扰加入硝酸银溶液产生浅黄色沉淀AgNO3+NaBr=AgBr↓+NaNO3
本题解析:
本题难度:一般
3、选择题 用如图装置进行实验,将液体A逐渐加入到固体B中,下列叙述正确的是
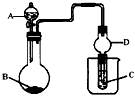
[? ]
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D.实验仪器D主要起到洗气的作用
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列实验方案设计中,可行的是(?)
A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉
B.用萃取的方法分离汽油和煤油
C.用溶解过滤的方法分离KNO3和NaCl固体的混合物
D.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2
参考答案:A
本题解析:略
本题难度:简单
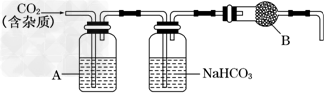
5、实验题 CaCO3广泛存在于自然界,是一种重要的化工原料.大理石主要成分为CaCO3,另外有少量的含硫化合物.实验室用大理石和稀盐酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6?mol/L),应选用的仪器是________.
a.烧杯? b.玻璃棒 c.量筒? d.容量瓶
(2)上述装置中,A是________溶液,NaHCO3溶液可以吸收________.
(3)上述装置中,B物质是________.用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果______(填“偏高”、“偏低”或“不受影响”).
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的?主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重为了将石蜡和碳酸钙溶出,应选用的试剂是________.
a.氯化钠溶液? b.稀醋酸 c.稀硫酸? d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________.
(6)上述测定实验中,连续________,说明样品已经恒重.
参考答案:(1)abc
(2)CuSO4溶液或酸性KMnO4溶液;HCl气体或酸性气体
(3)无水CaCl2;偏低
(4)bd
(5)石蜡;CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
本题解析:
本题难度:一般
|