1、选择题 接触法制硫酸的沸腾炉出来的炉气必须经过净化处理,其正确过程是
[? ]
A.洗涤、干燥、除尘
B.干燥、除尘、洗涤
C.除尘、洗涤、干燥
D.除去硒和砷的化合物
2、选择题 除去CO2中的HCl杂质最好是将混合气体通过足量的( )
A.饱和NaOH溶液
B.饱和NaHCO3溶液
C.饱和Na2CO3溶液
D.水
3、填空题 (13分)一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
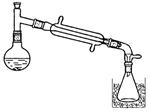
某学生的实验过程和具体操作可简述如下:
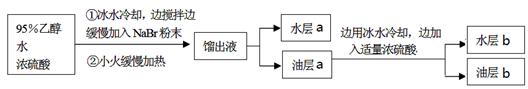
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是?。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有?,检验该离子的方法是??。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
实验步骤
| 预期现象和结论
|
步骤1:将油层b转移至?中,再加入足量稀 Na2SO3溶液充分振荡,静置。
| ?
|
步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。
| 溶液分层,下层呈橙红色,证明?。
|
步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中,?至温度计升高至450C左右。
| 馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。
|
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率?(用小数表示,保留二位小数)。
4、选择题 除去Na2CO3固体中少量NaHCO3的最佳方法是
A.加入适量盐酸
B.加入NaOH溶液
C.加热
D.配成溶液后通入CO2
5、实验题 (8分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们,做了以下实验。
(1)将固体溶于水,搅拌后得到无色透明溶液;
(2) 往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3) 过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解,试判断:
①.固体混合物中肯定有?;肯定没有?;可能有??;对可能有的物质,可采用往滤液中滴加?试剂的方法来检验。
②.操作(2)中反应的离子方程式?。
③.操作(3)中反应的化学方程式?。