1、选择题 在元素周期表中短周期的X和Y两种元素可组成化合物XY3,则下列说法正确的是
A.XY3晶体一定是分子晶体
B.XY3中各原子的最外层一定满足8电子的稳定结构
C.X和Y一定不属于同一主族
D.Y原子序数为m,X原子序数可能是m±4或m+6 或m+8等
参考答案:D
本题解析:
正确答案:D
A、可能是离子化合物,如AlF3;B不正确,AlCl3中铝不是8电子的稳定结构,C、SO3中O、S在同一族。
本题难度:一般
2、填空题 A、B、C、D、E是五种原子序数依次递增的短周期元素,已知:其中只有一种是金属元素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素原子质子数的2倍;B的最外层电子数是电子层数的两倍;C、A可形成两种常见的液态化合物甲和乙,且相对分子质量乙比甲大16。
(1)E元素的名称为:?;D的原子结构示意图为?。
(2)化合物乙中含有的化学键是?(填“极性共价键”或“非极性共价键”)。
(3)A单质与B、C形成的化合物可合成一种新型汽车动力燃料甲醇。
已知CO(g)+1/2O2(g)=CO2(g)
ΔH=-283 kJ/mol
H2(g)+1/2O2(g)===H2O(g)?ΔH=-242 kJ/mol
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-651 kJ/mol
写出A与所选化合物合成甲醇的热化学方程式:?。
(4)EC2与C、D形成的化合物发生氧化还原反应的化学方程式为:?。
参考答案:(1)硫?
(2)极性共价键、非极性共价键
(3)CO(g)+2H2(g)=CH3OH(g)?ΔH=-116 kJ·mol-1
(4)Na2O2+SO2=Na2SO4
本题解析:短周期元素中同种主族元素的C、E两种元素,E的原子序数是C的2倍,E为S,C为O;B的最外层电子数是电子层数的两倍,且B的原子序数小于C,B为碳元素;A与O元素形成两种常见的液态化合物,A为H,D为Na,乙为H2O2,甲为H2O。
(1)Na的原子结构示意图为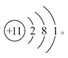
(2)H2O2中含有的化学键为极性共价键、非极性共价键。
(3)H2与CO反应制备CH3OH的热化学方程式,根据
CO(g)+1/2O2(g)=CO2(g)?ΔH=-283 kJ/mol?①?
H2(g)+1/2O2(g)=H2O(g)?ΔH=-242 kJ/mol?②
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)?ΔH=-651 kJ/mol ③可知,①+②×2-③即得该热化学方程式CO(g)+2H2(g)=CH3OH(g)?ΔH=-116 kJ·mol-1。
(4)SO2与Na2O2发生氧化还原反应生成Na2SO4,反应的化学方程式为Na2O2+SO2=Na2SO4。
本题难度:一般
3、选择题 下表列出的是部分元素的原子序数,有关该表的下列说法正确的是(?)
9
| 10
| 11
|
17
| 18
| 19
A.每一横行元素原子的电子层数都不相同
B.每一纵行元素原子的最外层电子数都不相同
C.中间的纵行元素很不容易与其他元素化合
D.左边纵行元素的金属性很强
|
题型:单选题难度:偏易来源:不详 答案 第一横行中的9、10有2层电子,11有3层电子;第二横行中的17、18有3层电子,19有4层电子。每一纵行元素原子的最外层电子数都相同,分别为7、8、1。中间的纵行元素是稀有气体Ne、Ar,很不容易与其他元素化合。左边纵行元素分别是F、Cl,非金属性很强。
马上分享给同学