1、选择题 根据元素的原子序数,可推知原子的是:
①质子数?②中子数?③质量数?④核电荷数?⑤核外电子数
A.①②③
B.①④⑤
C.②③④
D.③①⑤
参考答案:B
本题解析:考查元素原子的组成。原子序数等于质子数等于核外电子数等于核电荷数,所以答案是B。
本题难度:简单
2、选择题 已知A、B、C、D、E是短周期原子序数依将增大的5种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物的难排于水。下列说法不正确的是?(?)
A.简单离子的半径:C>D>E>B
B.工业上常用电解法制得C和D的单质
C.稳定性: A2B>A2E
D.单质D可用于冶炼某些难熔金属
参考答案:A
本题解析:略
本题难度:简单
3、选择题 某元素R的最高价氧化物的水化物分子式是HnRO2 n-2,则在气态氢化物中R元素的化合价是?
A.3n-10
B.12-3n
C.3n-4
D.3n-12
参考答案:D
本题解析:略
本题难度:简单
4、选择题 短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,三种元素原子的最外层电子数之和为13。下列判断正确的是
A.元素X位于第2周期第ⅣA族
B.元素X分别与Y、Z形成的化合物都不止一种
C.单核离子半径大小顺序:X>Y>Z
D.Z的最简单氢化物的稳定性比X的强
参考答案:B
本题解析:Y为IA族元素,最外层电子数为1,X、Z同主族,最外层电子数相同,因三种原子最外层电子数之和为13,故X、Z的最外层电子数为6,应为O、S;所以X、Y、Z分别为O、Na、S;据此可知:A、元素X应位于第2周期第VIA族,错误;B、O与Na可形成Na2O和Na2O2、O和S可形成SO2和SO3,正确;C、三种元素的离子半径应为:S2->O2->Na+,错误;D、S比O非金属性弱,故氢化物稳定性弱,D错误。
本题难度:一般
5、选择题 已知A2-核内有x个中子,A原子的质量数为m,则n g A2-所含电子的总物质的量是(?)
A.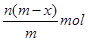
B.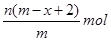
C.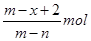
D.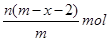
参考答案:B
本题解析:根据质量数=质子数+中子数可以得到,A2-核内有x个中子,A原子的质量数为m,所以A2-质子数为m-x,一个A2-的电子数目为m-x+2,所以n g A2-所含电子的总物质的量是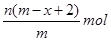 ,答案选B。
,答案选B。
本题难度:一般