1、选择题 下列反应的离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O =AlO2- + 4NH4+ + 2H2O
B.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3- =CaCO3↓ + H2O
C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ + CO2↑ + H2O
D.氯化铁溶液中加入单质铜:Fe3++Cu= Fe2+ + Cu2+
参考答案:B
本题解析:试题分析:氨水是弱电解质,不能溶解Al(OH)3,A项错误;醋酸是弱电解质,不能拆,C项错误;D项电荷不守恒。答案选B。
考点:离子反应正误判断
点评:离子方程式正误判断要注意:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:简单
2、选择题 某无色透明的溶液,在PH=0和PH=14的条件下都能大量共存的是
A.Fe2+、K+、NO3-、SO42-
B.Mg2+、NH4+、SO42-、Cl-
C.Na+、K+、NO3-、SO42-
D.Ba2+、Na+、NO3-、SO42-
参考答案:C
本题解析:分析:溶液无色,则有颜色的离子不能存在,PH=0的溶液呈酸性,PH=14的溶液呈碱性,在PH=0和PH=14的条件下都能大量共存,说明离子既不与H+反应也不与OH-反应,则在两种溶液中都能大量共存.
解答:A.Fe2+有颜色,与溶液无色不符,故A错误;
B.在碱性条件下,Mg2+与OH-反应生成沉淀,NH4+与OH-反应生成NH3?H2O而不能大量共存,故B错误;
C.四种离子既不与H+反应也不与OH-反应,且离子之间不发生任何反应,在两种溶液中都能大量共存,故C正确;
D.Ba2+与SO42-反应生成BaSO4沉淀而不能大量共存,故D错误.
故选C.
点评:本题考查离子共存问题,题目难度不大,本题注意题目要求,此为解答该题的关键,也是易错点,学习中加强审题能力的培养.
本题难度:困难
3、选择题 下列各组离子因发生氧化还原反应而不能大量共存的是(? )
A.pH=1的溶液中:Fe2+、Al3+、K+、
B.某无色溶液中:K+、 、Cl-、
、Cl-、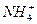
C.含有大量OH-的溶液中:Na+、Cu2+、 、
、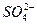
D.常温下由水电离出的c(H+)=10-10 mol·L-1的溶液中:Na+、Cl-、F-、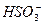
参考答案:A
本题解析:A项Fe2+与 发生氧化还原反应,不能大量共存;B项中各离子可以大量共存;C项中的OH-与Cu2+因发生复分解反应,而不能大量共存;D项,溶液可以是酸性的,也可以是碱性的,如果是酸性的,H+与F-、
发生氧化还原反应,不能大量共存;B项中各离子可以大量共存;C项中的OH-与Cu2+因发生复分解反应,而不能大量共存;D项,溶液可以是酸性的,也可以是碱性的,如果是酸性的,H+与F-、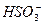 发生复分解反应,如果是碱性的,OH-与
发生复分解反应,如果是碱性的,OH-与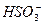 发生复分解反应,所以不论溶液显酸性还是显碱性,离子都不能大量共存。
发生复分解反应,所以不论溶液显酸性还是显碱性,离子都不能大量共存。
本题难度:简单
4、选择题 下列离子能在水溶液中大量共存的一组是
A.Fe3+、HCO3ˉ、Clˉ、SCNˉ
B.Ba2+、NO3ˉ、SO32ˉ、H+
C.Mg2+、NH4+、Brˉ、OHˉ
D.Na+、Cu2+、SO42ˉ、Clˉ
参考答案:D
本题解析:试题分析:Fe3+与HCO3ˉ易发生双水解反应,生成Fe(OH)3沉淀和CO2气体,Fe3+与SCNˉ易发生复分解反应或显色反应,生成属于弱电解质的Fe(SCN)3,故A错误;SO32ˉ与Ba2+易反应生成BaSO3沉淀,SO32ˉ与H+易反应生成SO2气体和H2O,SO32ˉ还易与NO3ˉ、H+发生氧化还原反应,生成SO42ˉ、NO、H2O,故B错误;OHˉ易与Mg2+反应生成Mg(OH)2沉淀,OHˉ易与NH4+反应生成NH3、H2O,故C错误;Na+、Cu2+、SO42ˉ、Clˉ之间不能反应,故D正确。
考点:考查离子共存。
本题难度:困难
5、填空题 (12分)1 L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子
| H+?NH4+?Al3+?K+
|
可能大量含有的阴离子
| Cl?-?Br-?I?ClO?AlO?2-
|
?(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生?沉淀和气体的物质的量( )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积( )的关系如右图所示。
)的关系如右图所示。

则该溶液中确定含有的离子有__ __?___? __;
__?___? __;
不能确定是否含有的阳离子有_______? ___,
要确定其存在可补充做的实验是______? _;
肯定不存在的阴离子有________? ___。
(2)经检测,该溶液中含有大量的 Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况)
| 2.8L
| 5.6 L
| 11.2 L
|
 (Cl-) (Cl-)
| 1.25mol
| 1.5 mol
| 2 mol
|
 (Br-) (Br-)
| 1.5 mol
| 1.4 mol
| 0.9 mol
|
 (I-) (I-)
| 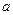 ?mol ?mol
|  0 0
| 0
|
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为__?_。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____?________。
参考答案:

本题解析:略
本题难度:一般