1、实验题 (1)Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程式为:___________________。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
方法一:
(2)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________________。
(3)除去蒸馏水中溶解的O2常采用____________的方法。
(4)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是_________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(5)在试管工里加入的试剂是_______________。
(6)在试管Ⅱ里加入的试剂是_______________。
(7)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
______________________。
(8)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________________。
参考答案:(1)4Fe(OH)2+O2+2H2O==4Fe(OH)3
(2)铁粉
(3)加热至沸腾
(4)防止空气随着NaOH溶液的加入进入溶液(或避免生成的Fe(OH)2沉淀接触O2)
(5)稀硫酸、铁屑
(6)NaOH溶液
(7)检验试管Ⅱ出口处排出的氢气的纯度,当排出的氢气的纯净时,再夹紧止水夹
(8)试管Ⅰ中反应生成的氢气充满了试管Ⅰ和试管Ⅱ且外界空气不易进入
本题解析:
本题难度:困难
2、实验题 某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
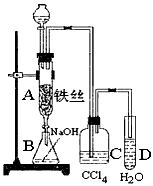
(1)写出A中反应的化学方程式:__________________________
(2)观察到A中的现象是:__________________________
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____________________,写出有关的化学方程式__________________________
(4)C中盛放CCl4的作用是__________________________
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_________________,现象是__________________________。
参考答案:(1)C6H6+Br2 C6H5Br+HBr↑
C6H5Br+HBr↑
(2)反应液微沸,有红棕色气体充满A容器
(3)除去溶于溴苯中的溴;Br2+2NaOH==NaBr+NaBrO+H2O(或2Br2+6NaOH==5NaBr+NaBrO3+3H2O) (4)除去溴化氢气体中的溴蒸气
(5)石蕊试液;溶液变红色
本题解析:
本题难度:一般
3、实验题 欲制无水氯化铝并保存备用。现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。请回答下列问题:
(1)设计的制取思路是:__________→__________→__________
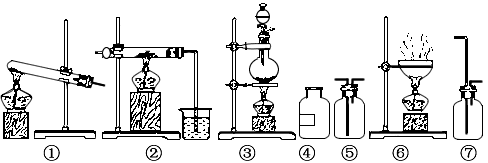
(2)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满)。
仪器编号:_______、_______、_______、_______、_______;
放入试剂:_______、_______、_______、_______、_______。
(3)该实验中装置有不足之处,请指出_________________________
参考答案:(1)制备氯气;净化和干燥氯气;制氯化铝
(2)仪器编号:③;⑦;⑤;②
放入试剂:NaCl;MnO2;浓H2SO4、NaCl;H2O、浓H2SO4、Al;NaOH;H2O
(3)②装置中制备装置与尾气吸收装置间缺少干燥装置
本题解析:
本题难度:困难
4、简答题 实验室合成乙酸乙酯粗产品的简易装置如右,由该实验可以得到乙酸乙酯粗产品.据此填空:
(1)反应中浓硫酸的作用是______
(2)实验结束时可用______(填仪器名称)将乙酸乙酯与饱和碳酸钠溶液分离
(3)如果以乙烯为原料,写出合成中发生反应的化学方程式及反应类型:______.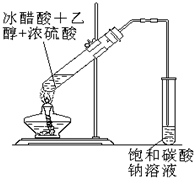
参考答案:(1)实验室制备乙酸乙酯时,发生:CH3CH2OH+CH3COOH
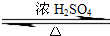
CH3COOCH2CH3+H2O,该反应为可逆反应,为提高反应物的产率,加入浓硫酸除起到催化剂的作用之外,还起到吸水剂的作用,有利于反应向正方向进行,提高产率,故答案为:催化剂、吸水剂;
(2)乙酸乙酯和饱和碳酸钠溶液互不相溶,可用分液的方法分离,用到的仪器为分液漏斗,故答案为:分液漏斗;
(3)用乙烯为原料制备乙酸乙酯时,先用乙烯和水发生加成反应制备乙醇,然后用乙醇氧化后生成乙酸,那么乙醇乙酸发生酯化反应和制备乙酸乙酯,发生的反应以及反应类型分别为:
CH2=CH2+H2O催化剂
本题解析:
本题难度:一般
5、实验题 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450 一500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
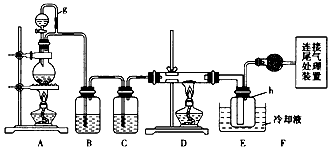
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
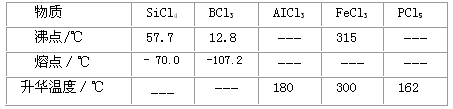
请回答下列问题:
(1)写出装置A中发生反应的离子方程式____。
(2)装置A中g管的作用是____;装置c中的试剂是____;装置E中的h瓶需要冷却的理由是______ 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是_____(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+, 再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2+ +MnO4- +8H+= 5Fe3++Mn2+ +4H2O
①滴定前是否要滴加指示剂?_____________(填“是”或“否”),请说明理由____
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 moI/LKMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20. 00 mL,则残留物中铁元素的质量分数是_______。
参考答案:(1)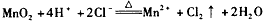
(2)平衡压强浓硫酸使SiCl4冷凝
(3)A1、P、Cl
(4)①否;KMnO4溶液自身可作指示剂;②4.480%
本题解析:
本题难度:困难