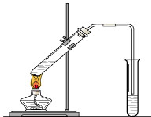
1、实验题 实验室制备苯甲醇和苯甲酸的化学原理是
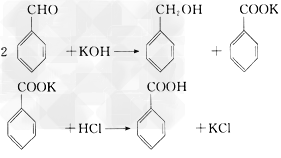
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示
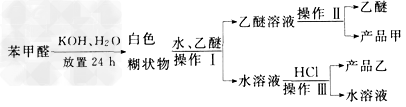
试根据上述信息回答下列问题:
(1)操作I的名称是________,乙醚溶液中所溶解的主要成分是____________;
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
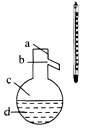
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是____(填“a”、“b”、“c” 或“d”),收集产品乙醚的适宜温度为____。
2、实验题 用A,B,C3套装置都可制取溴苯。请仔细分析3套装置,然后回答下列问题
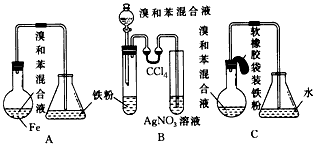
(1)写出3套装置中都发生反应的化学方程式_______________,_______________;写出B的试管中其他反应的化学方程式_____________________。
(2)装置A,C中长导管的作用是_____________________
(3)B,C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B装置应 进行的操作是__________________,对C装置应进行的操作是_______________________。
(4)A装置中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是__________________。
(5)B装置中采用了双球吸收管,其作用是_________________________;反应后,双球管中可能出现的现象是_______________________;双球管内液体不能太多,原因是__________________________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能准确进行。这两个缺点是:
____________________,_____________________。
3、实验题 过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:?
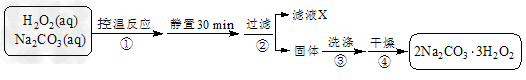
已知:主反应2Na2CO3?(aq)?+?3H2O2?(aq) 2Na2CO3·3H2O2?(s)?ΔH?<?0
2Na2CO3·3H2O2?(s)?ΔH?<?0
副反应?2H2O2?=?2H2O?+?O2↑
滴定反应?6KMnO4?+?5(2Na2CO3·3H2O2)?+19H2SO4?=3K2SO4?+?6MnSO4?+10Na2SO4?+?10CO2?↑?+?15O2↑?+?34H2O
50?°C时,2Na2CO3·3H2O2?(s)?开始分解
请回答下列问题:
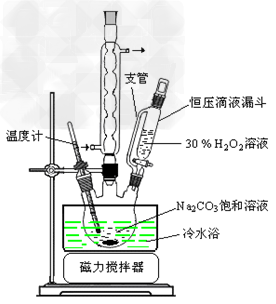
(1)图中支管的作用是___________。
(2)步骤①的关键是控制温度,其措施有__________、____________和___________。
(3)在滤液X中加入适量NaCl固体或无水乙醇,? 均可析出过碳酸钠,原因是__________。
(4)步骤③中选用无水乙醇洗涤产品的目的是____________。
(5)下列物质中,会引起过碳酸钠分解的有____________。
A.Fe2O3 B.CuO C.Na2SiO3 D.MgSO4
(6)准确称取0.2000?g?过碳酸钠于250?mL?锥形瓶中,加50?mL?蒸馏水溶解,再加50?mL?2.0?mol·L-1?H2SO4,用2.000×10-2?mol·L-1?KMnO4?标准溶液滴定至终点时消耗30.00?mL,则产品中H2O2的质量分数为_____________。
4、简答题 右图是实验室制乙酸乙酯的实验装置图:
(1)写出试管A中各试剂的名称______
(2)试管A中的要放入碎瓷片,作用是______该反应中的浓硫酸的作用是______
(3)在饱和Na2CO3溶液液面上观察到的现象是______使用饱和Na2CO3溶液的原因是:______
(4)分离产物的方法是______.使用到的玻璃仪器有______.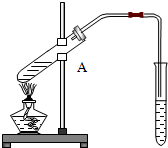
5、简答题 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式______;
(2)浓硫酸的作用是:①______;②______;
(3)饱和碳酸钠溶液的主要作用是______;
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止______.
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______.