1、选择题 下列各组离子能大量共存于同一水溶液中的是
A.HCO3-、Na+、K+、H+
B.NO3-、Cl-、Na+、Ag+
C.Mg2+、K+、NO3-、OH-
D.Cu2+、H+、Na+、Cl-
参考答案:D
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀等,则离子就能够大量共存,以此来解答.
解答:A、因HCO3-、H+能结合生成水和二氧化碳气体,则不能大量共存,故A错误;
B、因Cl-、Ag+能结合生成AgCl沉淀,则不能大量共存,故B错误;
C、因Mg2+、OH-能结合生成氢氧化镁沉淀,则不能大量共存,故C错误;
D、因该组离子之间不反应,则能大量共存,故D正确;
故选D.
点评:本题考查离子的共存问题,较简单,熟悉复分解反应发生的条件及离子的性质即可解答.
本题难度:困难
2、选择题 右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是(?)
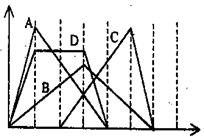
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
参考答案:D
本题解析:根据有关的方程式NaAlO2+HCl+H2O=Al(OH)3+NaCl、Al(OH)3+3HCl=AlCl3+3H2O可知,A正确;向澄清石灰水中通入CO2至过量的方程式是Ca(OH)2+CO2=H2O+CaCO3↓、CaCO3+H2O+CO2=Ca(HCO3)2,所以B正确;同样分析可知,C中氢氧化钠首先和盐酸反应,正确;D中反应的方程式是Ca(OH)2+CO2=H2O+CaCO3↓、2KOH+CO2=K2CO3+H2O、K2CO3+CO2+H2O=2KHCO3、CaCO3+H2O+CO2=Ca(HCO3)2,但D中图像不符合消耗CO2的物质的量,因此D不正确,答案选D。
点评:该题是中等难度的试题,试题贴近高考,难度较大,学生不易得分。该题的关键是准确写出有关反应的化学方程式,然后结合图像灵活分析、判断即可。
本题难度:一般
3、选择题 能用离子方程式H++OH-=H2O表示的反应是
A.Cl2+2NaBr=Br2+2NaCl
B.Na2CO3+2HCl=2NaCl+H2O+CO2↑
C.BaCl2+H2SO4=BaSO4↓+2HCl
D.NaOH+HNO3=NaNO3+H2O
参考答案:D
本题解析:强酸和强碱反应的离子方程式为H++OH-=H2O,B中有气体,C中有沉淀,A没有酸和碱。
本题难度:困难
4、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.碳酸氢钠溶液:NH4+、SO32-、AlO2-、Cl-
C.与硅反应产生大量氢气的溶液:Ca2+、K+、NO3-、F-
D.c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br-
参考答案:D
本题解析:试题分析:A项KNO3溶液在酸性条件下会Fe2+,不能与Fe2+共存;B项HCO3-不能与AlO2-存在,会生成CO32-与Al(OH)3;C项与硅反应产生大量氢气的溶液说明是强碱性溶液,Ca2+在强碱性条件下微溶,不能大量共存,同时不能与F-共同存在;D项c(H+)=1.0×10-13mol/L溶液说明是碱性溶液,K+、Na+、CH3COO-、Br-可以存在。
考点:考查溶液中的离子共存问题。
点评:本题涉及的隐含条件要找准,同时要清楚HCO3-在中性条件左右存在,强酸或强碱性不存在;NH4+一般在碱性条件下不存在,AlO2-一般只能在强碱性条件存在。属于中等难度题。
本题难度:一般
5、选择题 下列各组离子在指定溶液中可能大量共存的是
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②由水电离产生的c(H+)=1×10-12 mol·L-1的溶液中:Mg2+、SO42-、NO3-、Cl-
③加入Al能放出H2的溶液中:HCO3-、Na+、NO3-、Cl-
④能使pH试纸变为蓝色的溶液中:S2-、Na+、SO32-、Cl-
⑤含有大量Fe3+的溶液中:K+、Na+、AlO2-、SO42-
A.②④
B.②③
C.①⑤
D.①④
参考答案:A
本题解析:试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。①中Cu2+显蓝色,MnO4-显紫红色,不能大量共存;②中水的电离抑制,溶液可能显酸性,也可能显碱性,则根据离子的性质可知,能够大量共存;③中能和铝反应生成氢气的溶液,可能显酸性,也可能显碱性。其中HCO3-既能和反应,也能和碱反应。NO3-在酸性条件下和铝反应得不到氢气,均不能大量共存;④中能使pH试纸变为蓝色的溶液显碱性,可以大量共存;⑤中铁离子和AlO2-水解相互促进生成氢氧化铁和氢氧化铝沉淀,不能大量共存,答案选A。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单