1、选择题 关于4 ℃时在100 mL水中溶解了22.4 L HCl气体(标准状况下测得)形成的溶液,下列说法中正确的是
A.该溶液物质的量浓度为10 mol· L-1
B.该溶液物质的量浓度因溶液的密度未知而无法求解
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
参考答案:B
本题解析:考查物质的量浓度溶液的有关计算。氯化氢的物质的量是1.0mol,溶剂是100ml,但由于不能确定溶液的密度,因此无法确定溶液的体积,所以不能计算溶液的浓度,答案选B。
本题难度:简单
2、选择题 质量为1g的H2O中含m个氢原子,则阿伏加德罗常数的数值为(? )
A.m/9
B.9m
C.2m
D.m
参考答案:B
本题解析:1g水的物质的量是1/18mol,水是2个原子和1各氧原子构成的分子,所以氢原子的物质的量是1/9mol。由于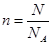 ,所以阿伏加德罗常数为9m mol-1,选项B正确,答案选B。
,所以阿伏加德罗常数为9m mol-1,选项B正确,答案选B。
本题难度:一般
3、选择题 pg某结晶水合物A?nH2O受热失去全部结晶水,质量变为qg,由此可以知道结晶水合物的式量为(?)
A.18pn/(p-q)
B.18pn/p
C.18 qn/p
D.18qn/(p-q)
参考答案:A
本题解析:考点:
专题:计算题;其它方法.
分析:据物质的化学式,利用组成中整体与部分组成的相对分子质量之比等于质量之比来解答.
解答:解:设结晶水合物A?nH20的相对分子质量为x,
结晶水合物的质量为P克,受热失去全部结晶水后,质量为q克,
则水的质量为(P-q)克,
则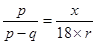
,解得x=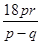 ,
,
故选A.
点评:本题考查学生利用物质的化学式及物质中的组成来计算物质的相对分子质量,明确组成中质量的关系是解答的关键.
本题难度:一般
4、选择题 下列物质各1mol,质量最大的是? (? )
A.O2
B.H2O
C.H2
D.CO2
参考答案:D
本题解析:略
本题难度:简单
5、选择题 NA表示阿伏加德罗常数,下列说法中正确的有
①20 g D2O含有的电子数为10NA?②常温下,4 g CH4含有NA个C-H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L CH3COONa溶液中水电离出的OH-的数目为0.01NA
⑥1 mol Na2O2与水完全反应时转移电子数为2NA
A.5个
B.2个
C.3个
D.4个
参考答案:C
本题解析:①20 g D2O物质的量为1mol,含有的电子数为10NA ,正确;②常温下,4 g CH4物质的量为0.25moL,含有C-H共价键0.25 ×4×NA=NA个,正确;③溶液稀释,密度也要变化,缺少密度数据无法计算稀释后溶液的质量分数,错误;④标准状况下,四氯化碳是液体,不能按气体进行计算,错误;⑤25 ℃时,pH=12的1.0 L CH3COONa溶液中c(OH-)为0.01mol/L,全部来源于水的电离,OH-的数目为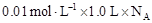 =0.01NA,正确;⑥ Na2O2与水反应是歧化反应,1 molNa2O2完全反应时转移电子数为NA,错误。正确选C。
=0.01NA,正确;⑥ Na2O2与水反应是歧化反应,1 molNa2O2完全反应时转移电子数为NA,错误。正确选C。
本题难度:一般