|
高考化学知识点整理《弱电解质电离平衡》高频试题特训(2019年最新版)(二)
2020-07-07 23:58:51
【 大 中 小】
|
1、选择题 下列物质中,不属于电解质的是
A.HCl
B.NaCl
C.KOH
D.蔗糖
|
参考答案:D
本题解析:略
本题难度:简单
2、填空题 (共10分)常温下,如果取0.1 mol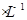 HA溶液与0.1mol HA溶液与0.1mol 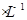 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题: NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
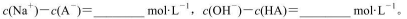
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);
参考答案:(每空2分,共10分)
(1)A-+H2O HA+OH- (2) 1.0×10-6mol·L-1 HA+OH- (2) 1.0×10-6mol·L-1
(3)9.9×10-7 1.0×10-8 (4) >
本题解析:
(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸, 生成的盐能水解导致溶液中OH-浓度大于H+浓度,溶液的pH值大于7,水解的离子方程式为A-+H2O HA+OH- HA+OH-
(2)该盐含有弱根离子能促进水的电离,溶液显碱性,溶液中的OH-都是由水电离所得,该溶液的PH=8,POH=6,则混合溶液中由水电离出的c( OH-)= 1.0×10-6mol·L-1
(3)由电荷守恒可知,c(Na+)-c(A-)=c(OH-)-c(H+)=10-6-10-8=9.9×10-7mol/L;0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合生成NaA溶液;测得混合溶液的pH=8,c(H+)=10-8mol/L;溶液显碱性,说明A-离子水解,溶液中存在质子守恒:c(OH-)=c(H+)+c(HA),则c(OH-)-c(HA)=c(H+)=10-8mol/L;
(4)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7。
考点:考查盐类的水解,酸碱混合时的守恒关系及有关PH的计算等知识。
本题难度:一般
3、填空题 (8分)实验表明,液态时,纯硫酸的电离能力强于硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答: H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是 。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4) 1×10-14(填“>”“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是 ,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混合酸中必然发生 (写离子方程式)反应而造成的。
参考答案:(1)2H2SO4 H3SO H3SO +HSO +HSO
(2)>
(3)HSO H++NO H++NO
本题解析:
本题难度:简单
4、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
| 电离平衡常数
(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是
A.HCN+CO32- =CN-+ HCO3-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
参考答案:D
本题解析:A.由于HCN的电离平衡常数K=4.9×10-10大于H2CO3的二级电离平衡常数Ki2=5.6×10-11而小于一级电离平衡常数Ki1=4.3×10-7,所以酸性:H2CO3> HCN > HCO3-;因此向Na2CO3的溶液中加入HCN,会发生反应:HCN+CO32- =CN-+ HCO3-,正确;B.由于HCOOH的电离平衡常数Ki=1.77×10-4>H2CO3的一级电离平衡常数Ki1=4.3×10-7;所以会发生反应:2HCOOH+CO32- = 2HCOO-+H2O+CO2↑;正确;C.由于甲酸、HCN都是弱酸,因为电离平衡常数HCOOH>HCN,所以当二者的体积相等、pH相等时,物质的量n(HCN)>n(HCOOH),中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,正确;D.在等体积、等浓度的HCOONa和NaCN溶液中,阴离子都发生水解反应而消耗,由于酸性HCOOH>HCN,所以溶液中c(HCOO-)>c(CN-);水解使溶液显碱性,水解程度越大,溶液的碱性就越强,因此溶液中的c(H+)前者大于后者,所含离子总数前者大于后者,错误。
考点:考查弱酸的电离平衡常数的应用及溶液中离子浓度的大小比较的知识。
本题难度:一般
5、选择题 缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液.下列有关该缓冲溶液的说法错误的是( )
A.加入少量强碱,发生反应HPO42-+OH-=PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+=H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.c(Na+)/2>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)/3
参考答案:A、当加入少量碱时,溶液中氢氧根离子和HPO42-发生中和反应生成PO43-,故A正确;
B、当加入少量酸时,发生的反应为PO43-+H+=HPO42-,故B错误;
C、溶液呈电中性,即阴阳离子所带电荷总数相等,所以c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故C正确;
D、只要Na2HPO4/Na3PO4的量一定,溶液中所有的含有P原子的微粒之和为一定值,当溶质为Na2HPO4时,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=2;当溶质为Na3PO4,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=3,所以Na2HPO4/Na3PO4的混合溶液中12C(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>13c(Na+),故D正确.
故选B.
本题解析:
本题难度:简单
|