|
|
|
高考化学知识点整理《弱电解质电离平衡》高频试题特训(2019年最新版)(一)
2020-07-07 23:58:51
【 大 中 小】
|
1、选择题 下列物质中,不属于电解质的是
A.HCl
B.NaCl
C.KOH
D.蔗糖
|
2、填空题 (共10分)常温下,如果取0.1 mol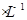 HA溶液与0.1mol HA溶液与0.1mol 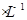 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题: NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:____(用离了方程式表示)。
(2)混合溶液中由水电离出的c(OH-)=____
(3)求出混合溶液中下列算式的精确计算结果(填具体数值):
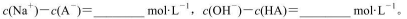
(4)己知NH4A 溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH3)2CO3溶液的pH_____7(填“>”、“<”或“=”);
3、填空题 (8分)实验表明,液态时,纯硫酸的电离能力强于硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答: H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是 。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4) 1×10-14(填“>”“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是 ,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混合酸中必然发生 (写离子方程式)反应而造成的。
4、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
| 电离平衡常数
(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是
A.HCN+CO32- =CN-+ HCO3-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
5、选择题 缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液.下列有关该缓冲溶液的说法错误的是( )
A.加入少量强碱,发生反应HPO42-+OH-=PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+=H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.c(Na+)/2>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)/3
|