1、选择题 某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1。由此可以得出的结论是
A.该有机物分子中C:H:O原子个数比为1:2:1
B.该有机物分子中C:H原子个数比为1:2
C.该有机物的相对分子质量为14
D.该有机物一定不含氧元素
参考答案:B
本题解析:
本题难度:简单
2、选择题 根据下列物质的名称,就能确认是纯净物的是
A.溴乙烷
B.二溴乙烷
C.已烯
D.淀粉
参考答案:A
本题解析:
本题难度:困难
3、选择题 将a?mol?C2H4跟b?mol?H2在密闭容器中、催化剂存在条件下反应若干时间后,生成了c?mol?C2H6,除去催化剂后,将此混合气体完全燃烧,生成CO2和H2O,所需氧气的物质的量应是
A.(3a+b)mol
B.(3a+0.5b-3.6c)mol
C.(3a+0.5b+3.6c)mol
D.(3a+0.5b)mol
参考答案:D
本题解析:分析:据元素守恒,反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,反应物为CO2和H2O,根据质量守恒可计算出最终消耗的氧气.
解答:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,
原混合物中含有C的物质的量为2amol,H的物质的量为4amol+2bmol,
根据反应物为CO2和H2O,1molC消耗1mol氧气,1molH消耗 mol氧气,
mol氧气,
则消耗的氧气的物质的量为:2amol+ amol+
amol+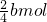 =(3a+0.5b)mol,
=(3a+0.5b)mol,
故选D.
点评:本题考查混合物的计算,题目难度不大,本题注意反应后混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,根据1molC消耗1mol氧气,1molH消耗 mol氧气计算.
mol氧气计算.
本题难度:简单
4、选择题 下列反应中,不属于加成反应的是
A.乙烯与氢气反应制取乙烷
B.甲烷与氯气反应制取一氯甲烷
C.乙烯与氯化氢反应制取氯乙烷
D.乙烯使溴的四氯化碳溶液褪色
参考答案:B
本题解析:根据反应的特点A、C、D属于加成反应,B属于取代反应,所以选B。
考点:有机化学反应类型
点评:取代反应:有机物分子里的某些原子或原子团被其他的原子或原子团所替代的反应。加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。消去反应:有机化合物在一定条件下,从一个小分子中脱去一个或几个小分子,而生成含不饱和键化合物的反应。
本题难度:困难
5、选择题 24mLH2S在30mLO2中燃烧,在同温同压下,得到SO2的体积为
A.24mL
B.30mL
C.20mL
D.18mL
参考答案:D
本题解析:H2S燃烧的化学方程式:
2H2S+O2(不足) 2S↓+2H2O?①
2S↓+2H2O?①
当O2过量时,继续发生化学反应
S+O2  ?SO2?②
?SO2?②
合并得
2H2S+3O2 ![]() ?2SO2+2H2O③
?2SO2+2H2O③
则当V(H2S)∶V(O2)≥2∶1时,只按①式进行。
当V(H2S)∶V(O2)≤2∶3时,只按③式进行。
当2∶3<V(H2S)∶V(O2)<2∶1时,可按①式和②式进行(如按①式和③式进行)。
解法一:2H2S+O2  ?2S↓+2H2O①
?2S↓+2H2O①
2H2S+3O2 ![]() ?2SO2+2H2O②
?2SO2+2H2O②
从①式考虑:2H2S?~? O2?~? 2S
24mL? 30mL
可知余O2为:30mL-12mL=18mL
余O2会继续与S反应生成SO2,由此可确定生成SO2的体积:
O2?~? SO2
18mL? 18mL
答案为D。
从②式考虑:2H2S?~? 3O2?~? 2SO2
20mL? 30mL? 20mL
余H2S的体积:24mL-20mL=4mL
因2H2S+SO2![]() ?2H2O+3S↓
?2H2O+3S↓
4mLH2S将消耗2mLSO2,剩余SO2为20mL-2mL=18mL。
解法二:H2S在O2中燃烧,按H2S与O2的体积比(或物质的量之比)不同,可发生不同的反应。
当V(H2S)∶V(O2)≥2∶1时:只发生2H2S+O2 ?2S↓+2H2O
?2S↓+2H2O
当V(H2S)∶V(O2)≤2∶3时:只发生2H2S+3O2 ?2SO2+2H2O
?2SO2+2H2O
现V(H2S)∶V(O2)=24∶30=4∶5,介于2∶1~2∶3之间,所以两个反应均发生。
设不完全燃烧H2S的体积为x,完全燃烧H2S的体积为y,则
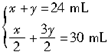 ?解得?
?解得?
由化学方程式知:生成SO2的体积等于完全燃烧的H2S的体积,即为18mL。
解法三:本题H2S与O2的体积之比为2∶1>V(H2S)∶V(O2)>2∶3,说明两种燃烧方式均存在,可根据题给H2S与O2的体积(或物质的量)之比写出总的反应方程式:
xH2S+yO2 ![]() ?xH2O+
?xH2O+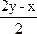 SO2+
SO2+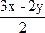 S
S
将x=24mL、y=30mL代入![]() ,
,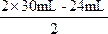 =18mL。
=18mL。
本题难度:困难