1、选择题 下列有关电池叙述正确的是
A.化学电池的反应本质是复分解反应
B.铅蓄电池放电时,是电能转变为化学能的过程
C.锌电锰干池碳棒是负极,锌片是正极
D.锌锰干电池工作一段时间后锌外壳逐渐变薄
参考答案:D
本题解析:化学电池的反应本质是氧化还原反应,A不正确;铅蓄电池放电时,是化学能转变为电能的过程,B不正确;锌电锰干池锌片是负极,碳棒是正极,C不正确;锌电锰干池锌片是负极,发生氧化反应而溶解,所以锌锰干电池工作一段时间后锌外壳逐渐变薄,D正确,答案选D。
点评:该题主要是考查学生对常见化学电池、原电池原理的熟悉了解程度,有利于培养学生的逻辑推理能力和发散思维能力,明确原电池的工作原理是答题的关键,注意相关知识的积累和归纳。
本题难度:一般
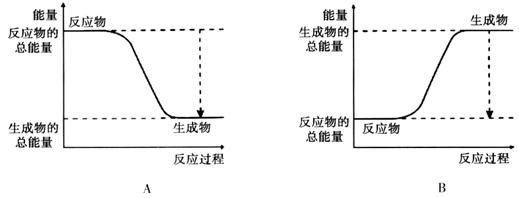
2、填空题 (12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键
| H—H
| O=O
| H—O
|
键能kJ/mol
| 436
| 496
| 463
|
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
参考答案:(1)A; 242 ; (2) Cu ;还原; 正; 0.2;
(3)0.2mol/(L.min) ; 2; 小于; 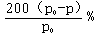 。
。
本题解析:(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,则反应物的能量高于生成物的能量,所以下图能正确表示该反应中能量变化的是A。则生成1mol水可以放出热量是2×463-436-496×1/2=242(KJ)。(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,由于在室温下Fe在浓硝酸中会发生钝化,所以活动性较弱的Cu作负极;若Zn、Ag和稀盐酸构成原电池,则活动性强的Zn作负极,Ag作正极,在正极上发生H+得到电子变为氢气,发生还原反应;根据同种电荷相互排斥,异种电荷相互吸引的原则,电解质溶液中阳离子移向负电荷较多的正极;质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中Zn作负极,被氧化,若一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。根据反应方程式Zn+Cu2+=Zn2++Cu,可知每消耗65g锌,在正极就产生64g的Cu,两个电极质量相差129g,转移电子2mol,现在二者质量差为12.9 g,所以导线中通过的电子的物质的量是0.2mol;(3)根据题意可知反应消耗A1.2mol,则同时会消耗B0.4mol,所以v(B)= 0.4mol÷2L÷1min=0.2mol/(L.min); v(C)= 0.4mol/L÷1min=0.4mol/(L.min); v(B):v(C)=1:2.所以x="2;" 若反应经2min达到平衡,因为反应是在体积固定的容器内进行,随着反应的进行,物质的浓度会减小,速率会减慢,所以前1minC变化浓度是0.4mol/L,后1min内C的浓度变化会小于0.4mol/L。因此若反应经2min达到平衡,平衡时C的浓度<0.8mol/L, 在体积固定的密闭容器内进行的化学反应,容器内气体的压强之比等于它们的物质的量的比。 3A(g)+B(g) 2C(g),
2C(g),
反应开始时气体的物质的量(mol) 3 1 0
反应消耗气体的物质的量(mol x x/3 2x/3
平衡时气体的物质的量(mol) 3-x 1-x/3 2x/3
[(3-x) +(1-x/3)+2x/3]÷(3+1)= p/p0;
解得x=6(p0-p)/ p0.
所以A的转化率是(x÷3)×100%={[6(p0-p)/ p0]÷3]} ×100%=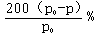 .
.
考点:考查原电池反应原理、反应热、方程式系数的确定、化学反应速率、物质的转化率的计算的知识。
本题难度:一般
3、填空题 原电池是一种______装置.电子的流动方向是从______极到______极;电流方向是从______极到______极.电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为在潮湿的空气中,铜与铝接触形成______,其中铝做______,很快被腐蚀.
参考答案:原电池是一种将化学能转化为电能的装置,在原电池中,电子的流动方向是从负极沿着导线流向正极,电流方向和电子流向相反,即从正极流向负极,铜、铝、潮湿的空气构成的原电池中,金属铝做负极,易被腐蚀.故答案为:将化学能转变为电能的;负;正;正;负;原电池;负极.
本题解析:
本题难度:一般
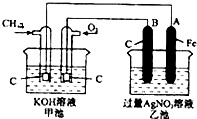
4、选择题 根据如图,下列判断中不正确的是( )
A.通入O2的电极的电极反应式为:O2+2H2O+4e-=4OH-
B.反应一段时间后,甲池中溶液的pH降低
C.乙池中电极B上发生还原反应
D.当乙池中的某一电极质量增加10.80g时,理论上甲池中消耗的气体至少为840mL(标准状况下)