1、选择题 将等质量的A,B两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装A份锌粉的试管中加入少量
CuSO4溶液。下图表示产生氢气的体积(V)与时间(t)的关系,其中正确的是
[? ]
A.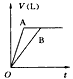
B.
C.
D.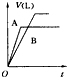
参考答案:D
本题解析:
本题难度:一般
2、填空题 已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸.按要求回答下列问题:
①电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因.
______.
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?______,若能,请写出电极反应式,负极______,正极______.若不能后面两空不填.
③若电池反应为:Cu+2H+=Cu2++H2,该电池属于原电池还是电解池?请写出电极材料和电解质溶液.______.
④有M、N两种金属分别与稀盐酸反应,产生氢气速率相近,请设计一个实验证明M、N两种金属的活泼性.______.
参考答案:①铜、铝的金属活泼性不同,遇到合适的电解质溶液易构成原电池,从而加快铝的腐蚀,所以不能把铜导线和铝导线连接在一起使用,
故答案为:形成原电池加速铝导线的腐蚀能;
②铜、石墨的活泼性不同且都导电,铜和硫酸铁能自发的进行氧化还原反应,所以铜、石墨、硫酸铁溶液能构成原电池,铜易失去电子发生氧化反应,所以铜作负极,石墨作正极,负极上的电极反应式为:Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,故答案为Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+;
③盐酸和稀硫酸不能和铜自发的发生氧化还原反应,铜和浓硫酸、浓稀硝酸不同生成氢气,所以铜和氢离子的反应不是自发的进行的氧化还原反应,所以只能是电解池中发生的反应,阳极上铜失电子,所以铜作阳极,电解质溶液中氢离子得电子发生还原反应,所以阴极上可以用碳棒作电极,电解质溶液为含氧酸,
故答案为:电解池,阳极铜,阴极碳棒,稀硫酸作电解液;
④活泼性不同的金属M、N都能够和盐酸反应放出氢气,且产生氢气速率相近,用M和N作电极、盐酸作电解质溶液形成原电池,根据电极产生气泡的情况确定金属的活泼性,
故答案为:M、N作电极,盐酸作电解液构成原电池,观察产生气泡情况.
本题解析:
本题难度:一般
3、选择题 在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是(?)
A.碳棒上有气体放出,溶液酸性变弱
B.a是负极,b是正极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了还原反应
参考答案:D
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以a电极是负极,失去电子,发生氧化反应,b电极是正极,所以选项D是错误的,其余选项都是正确的,答案选D。
本题难度:一般
4、选择题 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
[? ]
①在标准状况下,每消耗5.6L?CH4可以向外电路提供2mole- ②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O ③通过甲烷的电极为电池的正极,通过氧气的电极为负极 ④电池放电后,溶液pH不断升高
A.①②?
B.①③?
C.①④?
D.③④
参考答案:A
本题解析:
本题难度:一般
5、填空题 (12分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-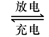 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是?;电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加?g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。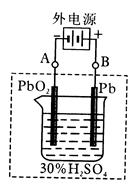
参考答案:(1)PbO2 + 2e- + 4H+ +SO42- = PbSO4 + 2H2O?小? 48
(2)Pb? PbO2?对换
本题解析:考查原电池和电解池的判断及有关计算。
(1)放电相当于原电池,充电相当于电解池。原电池中正极是得到电子,发生还原反应的,根据总反应式可知铅是负极,二氧化铅是正极。所以蓄电池中正极电极反应式为PbO2 + 2e- + 4H+ +SO42-= PbSO4 + 2H2O。放电时消耗硫酸,因此硫酸浓度将减小。负极电极反应式为Pb-2e-+SO42-= PbSO4,所以通过1mol电子时,负极质量增加为0.5mol×303g/mol-0.5mol×207g/mol=48g。
(2)根据装置图可判断A和电源的负极相连,作阴极,得到电子发生还原反应,电极反应式为PbSO4+2e-=Pb+SO42-。B和电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为PbSO4-2e-+ 2H2O = PbO2 + 4H+ +SO42-。所以A极生成铅,B极生成二氧化铅,因此蓄电池的正负极的极性将对换。
本题难度:一般