1、选择题 右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是

A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 510 kJ
D.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 91 kJ
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列反应属于放热反应的是
A.氢气还原氧化铜
B.氢气在氧气中燃烧
C.碳酸钙高温分解
D.氢氧化钾和氯化铵的反应
参考答案:B
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应,所以答案选B。
本题难度:简单
3、选择题 下列热化学方程式正确的是(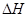 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)= SO2(g);△H=—269.8kJ/mol(反应热)
D.2NO2= O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:A错,燃烧热是指在常温常压下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;该反应中的产物水为水蒸气,是不稳定的氧化物,应改为液态水;B错,中和反应为放热反应,其△H=—57.3kJ/mol;C正确;D错,未指明反应物和生成物的状态;
本题难度:一般
4、选择题 已知:
①I2(g)+H2(g) 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固态碘的稳定性比气态碘的稳定性高
D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多
参考答案:C
本题解析:可逆反应不能进行完全,A项错误;根据盖斯定律,①-②得:I2(g)=I2(s) ΔH=-35.96 kJ/mol,B项错误;固态碘能量低于气态碘,故稳定性较高,C项正确;1 mol固态碘和1 mol气态碘中均含有1 mol I—I键,在反应中均全部断裂,D项错误
本题难度:一般
5、选择题 反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是
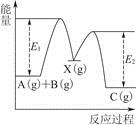
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
参考答案:A
本题解析:根据盖斯定律ΔH=ΔH1+ΔH2,即ΔH1=ΔH-ΔH2,再根据图像可知ΔH1>0,A项正确;从图中看出,X应为反应的中间产物,不是催化剂,B项错误;E2应为反应②的逆反应的活化能,C项错误。
本题难度:一般