1ЎўСЎФсМв ІОХХ·ҙУҰBrЈ«H2ЁDЎъHBrЈ«HөДДЬБҝ¶Ф·ҙУҰАъіМөДКҫТвНјЈ¬ПВБРРрКцЦРХэИ·өДКЗ(ЎЎЎЎ)

AЈ®Хэ·ҙУҰОӘОьИИ·ҙУҰ
BЈ®Хэ·ҙУҰОӘ·ЕИИ·ҙУҰ
CЈ®јУИлҙЯ»ҜјБЈ¬ёГ»ҜС§·ҙУҰөД·ҙУҰИИФцҙу
DЈ®ҙУНјЦРҝЙҝҙіцЈ¬ёГ·ҙУҰөД·ҙУҰИИУл·ҙУҰНҫҫ¶УР№Ш
2ЎўСЎФсМв Т»¶ЁМхјюПВЈ¬Ҫ«Т»¶ЁБҝөДAЎўBЎўCЎўDЛДЦЦОпЦКЈ¬ЦГУЪГЬұХИЭЖчЦР·ўЙъИзПВ·ҙУҰЈә
m A(s)Ј«n B(g)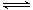 p C(g)Ј«q D(g)? ЎчHҙпөҪЖҪәвәуЈ¬ІвөГBөДЕЁ¶ИОӘ0.5 mol/LЎЈұЈіЦОВ¶ИІ»ұдЈ¬Ҫ«ГЬұХИЭЖчөДИЭ»эА©ҙуөҪФӯАҙөДБҪұ¶Ј¬ФЩҙОҙпөҪЖҪәвәуЈ¬ІвөГBөДЕЁ¶ИОӘ0.3molЎӨLЈӯ1ЎЈөұЖдЛьМхјюІ»ұдКұЈ¬CФЪ·ҙУҰ»мәПОпЦРөДМе»э·ЦКэ(
p C(g)Ј«q D(g)? ЎчHҙпөҪЖҪәвәуЈ¬ІвөГBөДЕЁ¶ИОӘ0.5 mol/LЎЈұЈіЦОВ¶ИІ»ұдЈ¬Ҫ«ГЬұХИЭЖчөДИЭ»эА©ҙуөҪФӯАҙөДБҪұ¶Ј¬ФЩҙОҙпөҪЖҪәвәуЈ¬ІвөГBөДЕЁ¶ИОӘ0.3molЎӨLЈӯ1ЎЈөұЖдЛьМхјюІ»ұдКұЈ¬CФЪ·ҙУҰ»мәПОпЦРөДМе»э·ЦКэ(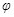 )УлОВ¶И(T)ЎўКұјд(t)өД№ШПөИзНјЛщКҫЎЈПВБРРрКцХэИ·өДКЗ
)УлОВ¶И(T)ЎўКұјд(t)өД№ШПөИзНјЛщКҫЎЈПВБРРрКцХэИ·өДКЗ
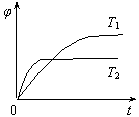
AЈ®ИИ»ҜС§·ҪіМКҪЦРЈәnЈјpЈ«q
BЈ®ИИ»ҜС§·ҪіМКҪЦРЈәЎчHЈҫ0
CЈ®ҙпЖҪәвәуЈ¬ФцјУAөДБҝЈ¬УРАыУЪМбёЯBөДЧӘ»ҜВК
DЈ®ИфT1ЎўT2Кұ·ҙУҰөДЖҪәвіЈКэ·ЦұрОӘK1ЎўK2Ј¬ФтK1ЈҫK2
3ЎўСЎФсМв ёщҫЭПВБРИИ»ҜС§·ҪіМКҪ
ЈЁ1Ј©C(s) + O2(g) ЈҪ CO2(g)? ЎчH1ЈҪЁC393.5 kJ/mol
ЈЁ2Ј©H2(g) + 1/2O2(g) ЈҪH2O(l)? ЎчH2ЈҪЁC285.8 kJ/mol
ЈЁ3Ј©CH3COOH(l) +2O2(g)ЈҪ2CO2 (g) + 2H2O(l)? ЎчH3ЈҪЁC870.3kJ/mol
ҝЙТФјЖЛгіц2C(s) + 2H2(g)+ O2(g)ЈҪCH3COOH(l)өД·ҙУҰИИОӘЈә
AЈ®ЎчH ЈҪ 244.1kJ/mol
BЈ®ЎчH ЈҪ-488.3kJ/mol
CЈ®ЎчH ЈҪ -996.6kJ/mol
DЈ®ЎчHЈҪ 996.6kJ/mol
4ЎўСЎФсМв ФЪ25ЎжЎў101kPa ПВЈәўЩ2Na(s) +1/2O2(g)=Na2O(s)? ЎчH1=Јӯ414KJ/molЈ»
ўЪ2Na(s) +O2(g)=Na2O2(s)? ЎчH2=Јӯ511KJ/molЎЈПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ?Ј©
AЈ®ўЩәНўЪЙъіЙөИОпЦКөДБҝөДІъОпЈ¬ЧӘТЖөзЧУКэПаН¬
BЈ®ўЩәНўЪЛөГчNa2O2ұИNa2OОИ¶Ё
CЈ®ўЩәНўЪІъОпөДТхСфАлЧУёцКэұИІ»ПаөИ
DЈ®25ЎжЎў101kPa ПВЈ¬Na2O2ЈЁsЈ©+2 NaЈЁsЈ©= 2Na2OЈЁsЈ© ЎчH=Јӯ317kJ/mol
5ЎўСЎФсМв ТСЦӘ H2(g) +Cl2(g) =2HCl(g)·ҙУҰ·ЕіцИИБҝОӘQ1Ј¬H2(g) +Br2(g)= 2HBr(g)·ҙУҰ·ЕіцИИБҝОӘQ2УР№ШЙПКц·ҙУҰөДРрКцХэИ·өДКЗЈЁ?Ј©
AЈ®Q1<Q2
BЈ®ЙъіЙОпЧЬДЬБҝҫщёЯУЪ·ҙУҰОпЧЬДЬБҝ
CЈ®ЙъіЙ1 mol HClЖшМеКұ·ЕіцQ1ИИБҝ
DЈ®1 mol HBr(g)ҫЯУРөДДЬБҝҙуУЪ1 mol HBr(l)ҫЯУРөДДЬБҝ