|
|
|
高考化学知识点整理《物质的量》考点强化练习(2019年押题版)(九)
2020-07-08 00:05:48
【 大 中 小】
|
1、实验题 甲学生急需3.0mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4mol·L-1浓硫酸。请你为他配制100mL 3.0mol·L-1稀硫酸。
(1)建议配制过程如下:计算所需浓硫酸的体积是_________,量取浓硫酸所用的量筒的规格是______(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL),该量取过程还将用到的玻璃仪器有___________________________。稀释。具体操作过程是_______________________。待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入_________________。用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。将蒸馏水注入容量瓶,待液面离容量瓶刻度线_________________,改用胶头滴管加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液的过程中,你分别遭遇到下列情况之一时,甲同学将把“偏高”、“偏低”或“标准”的结论反馈给你:
A.所用的浓硫酸长时间放置在密封不好的容器中____________
B.容量瓶用蒸馏水洗涤后残留有少量的水____________
C.所用过的烧杯、玻璃棒未洗涤____________ ?
D.定容时俯视刻度线____________ ?
2、选择题 V L硫酸铝溶液中含有Al3+mg,则溶液中SO42-的物质的量浓度为[ ]
A. mol/L mol/L
B. mol/L mol/L
C.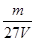 mol/L mol/L
D. mol/L mol/L
|
3、选择题 把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol/L
B.10( 2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L
|
4、选择题 2.2 g化合物A含有3.01×1022个A分子,则A的相对分子质量为( )
A.11
B.22
C.44
D.44 g/mol
5、计算题 硫酸是重要的化工产品,在基础化学实验中,有着重要的作用。
(1)物质的量浓度为18.4mol/L,质量分数为0.98的浓硫酸吸收水蒸气时,当其质量分数下降到0.87(密度1.8g?cm-3)以下时,则失去干燥能力。 质量分数为0.87的硫酸的物质的量浓度为
?(保留两位小数,下同)。50mL 18.4mol/L的浓硫酸作为干燥剂时,最多可吸水___________g。
(2)工业上以高岭土和硫酸.氨气为原料制取铵明矾[NH4Al(SO4)2·12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3 + 3H2SO4? → ?Al2(SO4)3 + 3H2O…………①
Al2(SO4)3 + H2SO4 + 2NH3 →? 2NH4Al(SO4)2…………②
某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时氧化铝和硫酸的物质的量之比是?
(3)硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为_____。
(4)将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率