1、选择题 室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是(?)
H++OH-。下列叙述正确的是(?)
A.将水加热,平衡正向移动,KW变小
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大
C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大
D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大
参考答案:B
本题解析:A项,加热后KW变大,不正确;C项,新制氯水久置后,水的电离平衡向左移动,c(OH-)减小,不正确;D项,KW不变,不正确。
本题难度:一般
2、填空题 (8分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是??。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:负极的电极反应式是??。
(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,充电时:阳极反应式:?用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:?
2PbSO4+2H2O,充电时:阳极反应式:?用此装置电解水和重水(D2O)组成的混合液(两电极均是Pt),通电一段时间后,在两极共收集到33.6 L(标准状况)气体,总质量为18.5 g,则混合气体中H原子和D原子个数之比:?
参考答案:(1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(2)N2H4+4OH--4e-=4H2O+N2↑
(3)PbSO4-2e-+2H2O==PbO2+SO42-+4H+? 3∶1
本题解析:(1)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。32.0gN2H4的物质的量就是1mol,所以N2H4的燃烧热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol;(20在燃料电池中,通入燃料的电极是负极,根据题意,在碱性环境中,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑;(3)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O
2PbSO4+2H2O,[充电时:阳极发生氧化反应,该电极的电极反应式PbSO4-2e-+2H2O==PbO2+SO42-+4H+; (4)电解水的方程式是2H2O 2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
2H2↑+O2↑。n(气体)=33.6 L÷22.4L/mol=1.5mol,则产生氧气0. 5mol,其质量16g,产生氢气1mol,质量是2.5 g.即1mol的H原子,质量是1.25 g,根据十字交叉法可得H:D=3:1。
本题难度:简单
3、填空题 (14分)
(1)25 ℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为?
已知25 ℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH=10,溶液中各离子的物质的量浓度由大到小的顺序为?。
(2))若100 ℃时,KW=10-12,则100 ℃时pH=11的Ba(OH)2溶液与pH=2的硫酸按体积比1:9混合充分反应后pH=?;若该温度下10体积的pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系为? ?。
?。
(3)某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示。
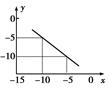
该温度下水的离子积为?。该温度下氯化钠溶液的pH为?
该温度下0.01 mol/L NaOH溶液的pH为?。
参考答案:(14分)每空2分
(1)的体积比为? 1∶9?浓度由大到小的顺序为? c(Na+)>c(A-) >c(OH-) >c(H+)
(2)pH=? 9?; a与b之间应满足的关系为? a+b="13?"
(3)水的离子积为? 10-15 mol2·L-2? pH为? 7.5? ?pH为? 13
?pH为? 13
本题解析:略
本题难度:一般
4、选择题 25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是?(?)
A.HA酸溶液的pH值一定等于1
B.HA酸溶液的物质的量浓度一定等于0.1mol/L
C.中和后溶液中M+离子浓度一定等于A-离子浓度
D.中和后生成的盐MA一定没有发生水解
参考答案:C
本题解析:因酸碱都是一元的,所以恰好完全反应。由于酸HA的强弱不明确,要具体分析。若HA是强酸,则c=0.1mol/L,pH=1,此时A、B正确;若HA是弱酸,则c>0.1mol/L,MA水解。但,无论HA是强酸还是弱酸,溶液中的电荷恒等式c(H+)+c(M+)=c(OH-)+c(A-)总是成立的。
本题难度:一般
5、选择题 下列溶液一定显中性的是
A.将pH=5的盐酸稀释100倍后所得的溶液
B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液
C.由强酸、强碱按等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
参考答案:B
本题解析:酸稀释不可能显中性一定PH<7,c(H+)=c(OH-)一定为中性。由强酸、强碱按等物质的量反应得到的溶液,要看是几元酸和碱。非电解质NH3溶于水得到的溶液显碱性,SO3溶于水显酸性。
本题难度:一般