1、选择题 某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
A.c(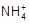 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
B.c(Cl-)>c(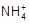 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
C.c(Cl-)>c(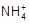 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c(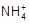 )+c(H+)=c(Cl-)+c(OH-)
)+c(H+)=c(Cl-)+c(OH-)
参考答案:D
本题解析:氨水和盐酸发生中和反应生成氯化铵和水,则根据电荷守恒可知c(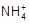 )+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(
)+c(H+)=c(Cl-)+c(OH-),所以选项D正确,AB不正确;由于氨水是弱碱,且a+b=14,所以在反应中氨水是过量的,溶液显碱性,应该是c(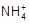 )>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
)>c(Cl-)>c(OH-)>c(H+),C不正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确酸碱中和后溶液酸碱性的判断,首先要判断酸碱的过量问题。只有当酸碱恰好反应时,才能考虑生成的盐是否水解,其次要利用好电荷守恒、物料守恒以及质子守恒。
本题难度:一般
2、选择题 甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
A.a的浓度必小于乙酸的浓度
B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度
D.b的浓度与乙酸的浓度无法比较
参考答案:AD
本题解析:当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍,这说明甲酸的酸性强于乙酸的。又因为pH越小,酸性越强,则pH从大到小依次为a、乙酸、b可知,甲酸a的浓度一定小于乙酸的,但甲酸b的浓度不能确定,答案选AD。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生解题能力和技巧的培养和训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力和学习效率。该题的关键是明确pH与溶液酸碱性强弱的关系,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸,测得混合溶液的部分pH如下表所示:
序号
| 氢氧化钡溶液的体积/mL
| 盐酸的体积/mL
| 溶液的pH
|
①
| 22.00
| 0.00
| 8
|
②
| 22.00
| 18.00
| 7
|
③
| 22.00
| 22.00
| 6
|
假设溶液混合前后的体积变化忽略不计,则c为
A.3? B.4? C.5? D.6
参考答案:B
本题解析:①中氢氧化钡的pH值为8,则氢氧根离子的浓度为10-4,而题目中a+b=12,所以中性时,溶液为pH=6,③中溶液达到中性,而盐酸的体积与氢氧化钡的体积相等,则盐酸的氢离子浓度与氢氧化钡的氢氧根离子浓度相等,则pH=4。
点评:本题需要选取正确的有效信息进行计算,计算难度不大,属于简单。
本题难度:一般
4、选择题 下列热化学方程式中的△H能表示可燃物的燃烧热的是
[? ]
A.H2(g)+ Cl2(g)=2HCl(g) △H=-184KJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3J·mol-1
C.CO(g)+1/2O2(g)=CO2(g) △H2=-293KJ·mol-1
D.2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-1
参考答案:C
本题解析:
本题难度:简单
5、填空题 (1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是________。
(2) pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快?B.H2SO4最快? C.CH3COOH最快?D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是?。
(4)已知:酸性H2CO3>HClO>HCO,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO)>c(H+)>c(OH-)?
B.c(HCO)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+c(CO)
参考答案:(1) ③
(2) ①CH3COOH ?②CH3COOH ?③D
(3) 2×10-7 ? NaClO<NaHCO3<CH3COONa
(4) C
本题解析:
(1)碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,当盐酸过量时,碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以溶液中碳酸氢根离子浓度的变化是:先增大后减小,故选③;
(2)①一元酸中,强酸的浓度和氢离子浓度相等,弱酸中酸的浓度大于氢离子浓度;二元酸中,氢离子浓度为强酸浓度的2倍,所以pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液中物质的量浓度最大的是醋酸,故答案为:醋酸;
②pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液中,醋酸是弱电解质,所以醋酸的浓度最大,中和相同体积、相同pH值的三种酸,醋酸需要的氢氧化钠最多,
故答案为:CH3COOH;
⑶纯水中c(OH-)=c(H+)=2×10-7mol/L,酸性:CH3COOH> H2CO3> HClO,对应水解,由弱到强,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是NaClO<NaHCO3<CH3COONa;
⑷A、不正确,溶液应呈碱性;B、不正确,ClO―水解能力弱,c(ClO-)>c(HCO)> c(OH-);C、正确;是物料守恒;D、不正确,电荷守恒应为c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+2c(CO)。
本题难度:简单