1、选择题 放射性核素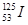 可用于治肿瘤,该核素中子数是(? )
可用于治肿瘤,该核素中子数是(? )
A.19
B.53
C.72
D.125
参考答案:C
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以中子数是125-53=72,答案选C。
本题难度:简单
2、填空题 (10分)元素A的原子的L层比M层多6个电子,元素B的L层比K层多5个电子,则A的元素符号为?,B的原子结构示意图是?,A和B两元素形成的化合物的电子式是?,它们形成的化合物中含有的化学键类型为___? ___(填“离子键”或“共价键”),该化合物属于________化合物(填“离子”或“共价”)。
参考答案:Mg, ?,
?, ,离子键,离子
,离子键,离子
本题解析:元素A的原子的L层比M层多6个电子,则A是镁。元素B的L层比K层多5个电子,则F,其原子结构示意图是 。镁是活泼的金属,F是活泼的非金属,形成的化学键是离子键,其相应化合物是离子化合物,电子式为
。镁是活泼的金属,F是活泼的非金属,形成的化学键是离子键,其相应化合物是离子化合物,电子式为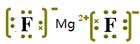 。
。
本题难度:一般
3、填空题 (12分)根据下列某些短周期元素中元素性质的有关信息,回答下列问题:
?
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
| ⑨
| ⑩
|
原子半径
/10-10m
| 0.37
| 1.86
| 0.74
| 1.43
| 0.77
| 1.10
| 0.99
| 1.52
| 0.75
| 0.71
|
最高价态
| +1
| +1
| ?
| +3
| +4
| +5
| +7
| +1
| +5
| ?
|
最低价态
| -1
| ?
| -2
| ?
| -4
| -3
| -1
| ?
| -3
| -1
|
(1)元素①②⑧的第一电离能由大到小的顺序是 ;元素③⑥⑨的电负性由大到小的顺序是 (以上均用元素符号填空)。
(2)元素⑤⑥⑦中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 (写化学式)。
(3)某元素R 的原子半径为1.02×10-10m,它与钠形成Na2R2,若物质Na2R2是一种含有非极性共价键的离子化合物,其电子式是 (R用元素符号表示)。
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以 杂化轨道成键。
(5)元素⑤的原子基态电子排布式为 。
参考答案:(1) H、Li、Na ;O、N、P ,(2)? CCl4、PCl3?
(3) ?(4)
?(4)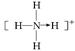 ?sp3?(5)? 1s22s22p2
?sp3?(5)? 1s22s22p2
本题解析:(1)元素①②⑧分别是H、Na、Li。同主族自上而下金属性逐渐增强,所以第一电离能由大到小的顺序是 H、Li、Na。元素③⑥⑨O、P、N,由于非金属性越强,电负性越大,所以电负性由大到小的顺序是O、N、P。
(2)元素⑤⑥⑦分别是C、P、Cl,由于只要分子中元素化合价的绝对值和该元素绝对值的之和满足8,即能使每个原子都满足最外层为8电子稳定结构,所以符合条件的是 CCl4、PCl3。
(3)与钠形成Na2R2,则R的化合价是-1价。又因为R 的原子半径为1.02×10-10m,所以原子半径及化合价可知,R是硫元素,因此电子式为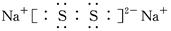 。
。
(4)①⑨形成的是NH4+,所以结构式为 ,其结构是正四面体,所以氮原子是sp3杂化。
,其结构是正四面体,所以氮原子是sp3杂化。
(5)元素⑤是碳,根据构造原理可知,碳原子的基态电子排布式为1s22s22p2。
本题难度:一般
4、选择题 元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物可能的化学式是
A.B2A3
B.B2A
C.BA2
D.BA
参考答案:A
本题解析:略
本题难度:一般
5、填空题 X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
元素
| 相关信息
|
X
| X的基态原子L层电子数是K层电子数的2倍
|
Y
| Y的基态原子最外层电子排布式为:nsnnpn+2
|
A
| Z存在质量数为23,中字数为12的核素
|
W
| W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色
|
(1)W的原子结构示意图为________。
(2)X的电负性比Y的____________(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是______________(写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式:________________.
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称:____________。氢元素,X、Y的原子也可共同形成多种分子和几钟常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:_______________。
参考答案:⑴?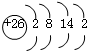 ?⑵小? H2O?⑶2Na2O2+2CO2=2Na2CO3+O2
?⑵小? H2O?⑶2Na2O2+2CO2=2Na2CO3+O2
⑷ 丙烷(或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等)?
CH3COOH+HCO3-===CH3COO-+H2O+CO2↑(其他合理答案也给分)
本题解析:X的基态原子L层电子数是K层电子数的2倍,则X是碳元素。Y的基态原子最外层电子排布式为:nsnnpn+2,其中n=2,则Y应该是氧元素。Z存在质量数为23,中字数为12的核素,则质子数=23-12=11,即A是钠元素。W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色,所以W是铁元素。
(1)铁是26号元素,则其原子结构示意图为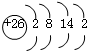 。
。
(2)非金属性越强,电负性越大,所以碳元素的电负性小于氧元素的电负性。非金属性越强,氢化物的稳定性越强,所以水的稳定性强于甲烷的稳定性。
(3)过氧化钠和CO2反应生成碳酸钠和氧气,反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2。
(4)在碳氢化合物中,如果核磁共振氢谱显示两种氢,则可以是丙烷或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等。氢元素,X、Y的原子也可共同形成多种分子和几钟常见无机阴离子,其中一种分子与该无机阴离子反应的离子方程式可以是CH3COOH+HCO3-===CH3COO-+H2O+CO2↑。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般