1、选择题 下列过程属于物理变化的是
A.煤的气化
B.蛋白质的颜色反应
C.油脂的皂化
D.金属钠的焰色反应
参考答案:D
本题解析:分析:物理变化只是物质的状态发生变化,而发生化学变化时有新物质生成.
解答:A、煤的气化是煤在高温下分解,是化学变化,故A错误.
B、蛋白质的颜色反应是蛋白质和浓硝酸的反应,是化学变化,故B错误.
C、油脂的皂化是油脂在碱性条件下的水解反应,是化学变化,故C错误.
D、金属钠的颜色反应是电子的跃迁,属于物理变化的范畴,故D正确
故选D.
点评:特别注意一些金属单质的颜色反应的实质是电子受到激发,属于物理变化.
本题难度:困难
2、选择题 下列关于元素周期律的说法错误的是
A.同一主族从上至下,元素的原子半径逐渐减小
B.同一周期从左至右,元素的原子半径逐渐减小(稀有气体除外)
C.同一周期从左至右,元素金属性逐渐减弱,非金属性逐渐增强。
D.同一主族从上至下,元素金属性逐渐增强,非金属性逐渐减弱
参考答案:A
本题解析:同主族元素自上而下原子半径是逐渐增大的,所以选项A是错误的,答案选A。
本题难度:简单
3、简答题 【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是?,属??区元素,它的最外层电子的电子排布图为?。
(2)XZ2分子的立体结构是?,YZ2分子中Y的杂化轨道类型为?,相同条件下两者在水中的溶解度较大的是?(写分子式),理由是?。
(3)含有元素N的盐的焰色反应为?色,许多金属盐都可以发生焰色反应,其原因是?。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。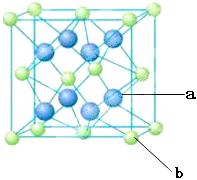
参考答案:(1)第三周期ⅥA族? P ?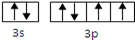
(2)V? sp? SO2? SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大。
(3)紫?电子由较高能级跃迁到较低能级时,以光的形式释放能量。
(4)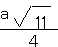
本题解析:第三周期ⅥA族,X、Y、Z、M、N、Q为元素周期表前四周期的六种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素。
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,最后1个电子填充p能级,属于p区元素,它的外围电子的电子排布图为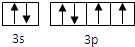 。
。
(2)SO2分子中S原子价层电子对数=2+(6-2×2)/2=3,S原子含有1对孤电子对,故其立体结构是V型,CO2分子C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大。
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量。
(4)
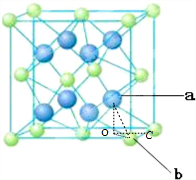
上下方向的平面:晶胞上底面、下底面、中间4个绿色球构成的平面、8个蓝色球构成立方体的上底面、下底面,这5个面之间的距离相等为 a pm,同理,左右方向形成的面间的距离相等为
a pm,同理,左右方向形成的面间的距离相等为 a pm,故a球到晶胞右侧面的距离为
a pm,故a球到晶胞右侧面的距离为 apm,到晶胞前面距离为
apm,到晶胞前面距离为 a pm,从a球向晶胞下底面作垂线,垂足为o,再作oc垂直棱,即oc为
a pm,从a球向晶胞下底面作垂线,垂足为o,再作oc垂直棱,即oc为 a pm,bc长为
a pm,bc长为 a pm,ao长为
a pm,ao长为 a pm,ab两球的距离=
a pm,ab两球的距离=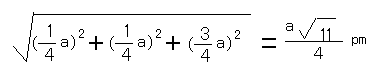
本题难度:一般
4、简答题 今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名称和符号;
(2)写出几种上述元素两两化合形成的化合物的化学式。
参考答案:(1)四种元素分别为氧、钙、钠、氯;其符号分别为O、Ca、Na、Cl。
(2)CaO、Na2O、Na2O2、CaCl2、NaCl等
本题解析:根据题目信息可知:甲元素是氧元素;乙元素的K、L、M、N层电子数分别是2、8、8、2,即为钙元素;丙元素为Na;丁元素为Cl。
本题难度:一般
5、选择题 X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20。下列判断正确的是
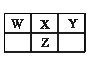
A.四种元素的原子半径:rZ>rX>rY>rW
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
参考答案:C
本题解析:设x的最外层电子数a,则w为a-1,Y为a+1,Z为a。解得a=5,所以,X为N、Y为O、Z为P、W为C。只有C正确。
本题难度:一般