1、选择题 下列各项中的“黄色”,不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的碘化钾溶液呈黄色
C.用玻璃片靠近在玻璃导管口燃着的硫化氢的火焰,玻璃片上附有的固体呈现黄色
D.食盐在无色的火焰上灼烧时,火焰呈黄色
参考答案:D
本题解析:A中由于浓硝酸分解的产物NO2溶解于其中,导致溶液呈黄色;B中因碘离子被氧化而产生碘单质而呈黄色;C中则由于H2S不完全燃烧而产生淡黄色的单质硫;D中则主要是焰色反应所导致的,属于物理现象.
本题难度:困难
2、选择题 某溶液中存在大量的Ba2+、Ag+、NH4+,该溶液中还可能大量存在的离子是
A.OH-
B.Cl-
C.SO42-
D.NO3-
参考答案:D
本题解析:试题分析:Ba2+与SO42-不能大量共存,Ag+与Cl-、SO42-不能大量共存,NH4+与OH-不能大量共存,所以可能存在的是NO3-,答案选D。
考点:考查离子共存的正误判断
点评:该题是基础性试题的考查,难度不大。试题注重基础,侧重能力的培养和训练,有利于培养学生的逻辑思维能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、填空题 围绕下列七种物质:①铝,②A12O3,③稀硝酸,④H2SO4,⑤Ba(OH)2固体,⑥氨水,⑦A12(SO4)3,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是?(填序号)。
(2)属于电解质的是?(填序号)。
(3)写出最适宜制取Al(OH)3的离子方程式?。
(4)两物质发生反应的离子方程式为H++OH—=H2O,请写出该反应的化学方程式?。
(5)34.2g⑦溶于水配成500mL溶液,溶液中SO42—的物质的量浓度为?。
(6)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的物质的量之比是?。
参考答案:(1)①②(共1分;答对1个给0.5分,答错一个不给分)
(2)②④⑤⑦(共2分;答对1个给0.5分,答错一个不给分)
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+(共2分)
(4)2HNO3+Ba(OH)2= Ba(NO3)2+2H2O(共2分)
(5)0.6mol/L(共2分;单位未写扣0.5分)
(6)1∶1(共1分)
本题解析:(1)Al、Al2O3既能与强酸反应,又能与强碱反应;(2)纯净的酸、碱、盐、金属氧化物属于电解质,单质、酸溶液、碱溶液不是电解质;(3)实验室常用铝盐溶液与氨水制取Al(OH)3,Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(4)H++OH—=H2O代表强酸与强碱结合生成可溶性盐和水的中和反应,2HNO3+Ba(OH)2= Ba(NO3)2+2H2O;(5)由m/M可知,n[A12(SO4)3]=0.1mol,由A12(SO4)3~3SO42—可知,n(SO42—)=0.3mol;由n/V可知,c(SO42—)=0.6mol/L;(6)铝元素全部由0价升高到+3价,被氧化,则Al是还原剂,1/4氮元素由+5价降低到+2价,被还原,则HNO3是氧化剂,则该反应中还原剂与氧化剂之比为1∶1。
本题难度:一般
4、填空题 (10分)现有A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子则可能是NO3-, SO42-, Cl-,CO32-离子中的某一种。
(1)若把四种盐溶解在四支试管中,只有C盐溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,B盐溶液中有沉淀生成,D盐溶液中有无色无味气体放出。
根据以上实验事实推断它们的化学式为:A?B?C?D?
写出B盐与盐酸反应的离子方程式?
参考答案:C
本题解析: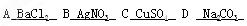

本题难度:一般
5、选择题 下列叙述正确的是? (? )
A.凡是离子化合物在离子方程式中都要以离子来表示
B.离子互换反应总是向着溶液中离子浓度减小的方向进行
C.酸碱中和反应的实质是H+和OH-结合生成水,故酸碱中和反应的离子方程式都是H++OH-=H2O
D.复分解反应必须具备离子反应生成的三个条件才能进行
参考答案:B
本题解析:A中的离子化合物质,如:Ca(OH)2等也要注意在溶液中是否主要以离子形式存在,才能使用离子形式表示;B中说明了离子反应的实质;C中只有强酸与强碱的中和反应才能用H++OH-=H2O表示,弱酸和弱碱都要使用分子式表示;D中复分解反应发生的三个条件之间是并列的关系,三者只要具备其一即可。因此只能选B。
本题难度:一般