|
高考化学必考知识点《离子共存》考点预测(2019年强化版)(八)
2020-07-08 00:22:17
【 大 中 小】
|
1、选择题 下列各组离子以适当比例混合,可以形成无色透明碱性溶液的是( )
A.Na+、 Ba2+、OH-、SO42-
B.Ag+、NH4+、OH-、NO3-
C.Mg2+、Na+、AlO2-、OH-
D.MnO4-、Al3+、SO42-、Cl-
|
参考答案:B
本题解析:A错,Ba2+与SO42-不能共存;B正确;C错,Mg2+与OH-不能共存;D错,MnO4-、Al3+、SO42-、Cl-的溶液为酸性溶液,且溶液呈紫红色;
本题难度:一般
2、选择题 在所给条件下下列各组离子能够大量共存的是
A.pH =0的无色溶液中:Fe3+、Mg2+、Cl-、SO42-
B.使甲基橙变红的溶液中:Na+、HCO3-、Cl-、NO3-
C.在有大量MnO4-溶液中:K+、Fe2+、SO42-、Cl-
D.投入Al有氢所放出的溶液中:Na+、Cl-、K+、SO42-
参考答案:D
本题解析:Fe3+呈黄色,HCO3-不能存在于酸性溶液,MnO4-会氧化Fe2+、Cl-故ABC错;Na+、Cl-、K+、SO42-既可大量存在于酸性溶液也可以存在于碱性溶液中,故D正确。
本题难度:一般
3、选择题 室温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中可能大量共存的是
A.NH4+、Fe2+、NO3-、SO42-
B.Ba2+ 、Na+、Cl-、NO3-
C.Na+、Cl-、SO42-、HCO3-
D.HCO3-、Na+、AlO2-、Cl-
参考答案:B
本题解析:解:由水电离产生的c(H+)和?c(OH-)满足c(H+)?c(OH-)=10-24,c水(H+)=10-12,为酸或碱溶液。A、酸溶液中不能大量存在AlO2-,故A错误;B、无论酸或碱溶液中该组离子之间不反应,能大量共存,故B正确;C、酸溶液中Fe2+、H+、NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,不能大量共存,故C错误;D、碱溶液中不能大量存在NH4+,故D错误。
本题难度:一般
4、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是(?)
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br -
D.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
参考答案:C
本题解析:A.NO3-、H+、Fe2+会发生氧化还原反应而不能大量共存。错误。B.甲基橙呈红色的溶液是酸性溶液,H+和AlO2-发生离子反应,不能共存。错误。C.c(H+)=10-12 mol·L-1的溶液是碱性溶液,离子不会发生任何反应。正确。D.加入苯酚显紫色的溶液中含有Fe3+,Fe3+和I-发生离子反应:2Fe3++2I-=2Fe2++I2不能共存。
本题难度:一般
5、选择题 请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是??。
②纯碱溶液呈碱性的原因是(用离子方程式表示)??。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式:??。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为??。
参考答案:1)①把一块pH试纸放在表面皿上,用玻璃棒蘸取待测液,点在试纸中央,待试纸发生颜色变化后与标准比色卡比较,即可确定溶液的pH。
②CO32-+H2O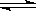 HCO3-+OH-、HCO3-+H2O HCO3-+OH-、HCO3-+H2O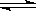 H2CO3+OH-(可不写) H2CO3+OH-(可不写)
(2)①C3H8(g)+5O2(g)=4H2O(l)+3CO2(g)? H=-2220.0kJ/mol?②2∶1。
本题解析:
1)①把一块pH试纸放在表面皿上,用玻璃棒蘸取待测液,点在试纸中央,待试纸发生颜色变化后与标准比色卡比较,即可确定溶液的pH。②纯碱溶液呈碱性的原因是碳酸根离子水解,多元弱酸根水解要分步写,用离子方程式表示:②CO32-+H2O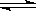 HCO3-+OH-、HCO3-+H2O HCO3-+OH-、HCO3-+H2O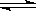 H2CO3+OH-(可不写) H2CO3+OH-(可不写)
(2)①1molC3H8燃烧放出的热量为222.0kJ ÷4.4g/44g·mol-1=2220.0kJ/mol ,反应的热化学方程式:C3H8(g)+5O2(g)= 4H2O(l)+3CO2(g) △H=-2220.0kJ/mol
②2∶1
解:令CH4、C3H8的物质的量分别是x、y
则有x+y=1mol,890x+2220y=1776.7,解得X=2/3mol,y=1/3mol,故混合气体中甲烷与丙烷的体积比为2:1.
本题难度:简单
|